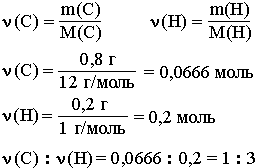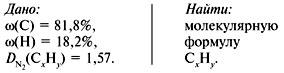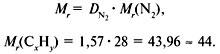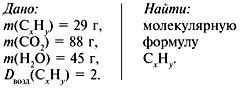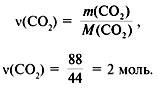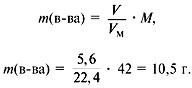Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
1. Цели.
-
Образовательные:
-
закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
-
научить студентов решать задачи на нахождение молекулярной формулы органического вещества;
-
сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
-
Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
-
Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для студентов, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4. Схема отчета:
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
6. Рекомендуемая литература:
-
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
-
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению :
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Решение
1. Записать условие задачи.
2. Найти массовую долю водорода:
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:
(C) =
(CO2) = 2 моль.
5. Найти количество вещества воды:
(H2O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
(H) = 2
(H2O),
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
(C) :
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
(H2O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C) :
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Решение:
-
Общая формула алканов CnH2n+2, общая формула монохлоралканов CnH2n+1Cl
-
Cоставим выражение для расчета массовой доли хлора:
М(Cl) 35,5
ω( Сl) =——————-=————-=0,3838 , откуда n=4
М(CnH2n+1Cl) 14n+36,5
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН2 – СН2 – СН2Сl 1-хлорбутан
СН3 – СН2 – СНCl– СН3 2- хлорбутан
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
|
СН3
СН3 – СCl – СН3 2-метил-2-хлорпропан
|
СН3
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Решение:
-
Общая формула монобромлканов CnH2n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
-
Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
-
Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Решение:
-
Уравнения реакций:
CnH2n + Н Сl = CnH2n+1Cl
CnH2n + Н Br = CnH2n+1Br
-
Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(CnH2n+1Cl) = n(CnH2n+1Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С3Н6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Решение:
-
Находим количество вещества алкена:
n(CnH2n) = 1,012/22,4 = 0,045 моль
-
По уравнению реакции
CnH2n +Сl2 = CnH2nCl2
n(CnH2nCl2)= n(CnH2n) =0,045 моль
-
М(CnH2nCl2)=m/n=5,09/0,045=113г/моль
12n +2n+71=113 n=3
Формула алкена С3Н6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
|
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода. |
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров. |
|
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу. |
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле. |
|
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного. |
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера. |
|
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного. |
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода. |
|
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода |
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана. |
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
I. Нахождение формулы органического вещества по массовой доле химических элементов и относительной плотности газов
1. Выпишите в тетрадь основные формулы
D2 = Mr(1)/Mr(2)
D — относительная плотность первого газа по второму (безразмерная величина).
Например:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%).
2. Разберите образец решения задачи
Этиловый спирт содержит 52,18% углерода:13,04% водорода: 34,78% кислорода. Плотность паров спирта по водороду 23. Определите формулу этилового спирта.
Решение:
1. Определим молекулярную массу искомого вещества:
Mr(CxHyOz) = D(H2) · Mr(H2)=23· 2 =46
2.По формуле n = (Wэлемента * Mr(вещества)) / Ar элемента * 100% вычислим число атомов C, H, O
n(C)=(52,18% · 46) / 12· 100% = 2
n(H)=( 13,04% · 46) /1· 100% =6
n(O)=( 34,78% · 46) / 16· 100% =1
Получаем x:y:z =2:6:1, следовательно, вещество C2H6O
Проверка, Mr(C2H6O)= 46
II. Нахождение формулы органического вещества по массовой доле химических элементов и плотности вещества при нормальных условиях
1. Выпишите в тетрадь основные формулы
M = ρ * Vm
где Vm =22,4 л/моль (при н.у.);
M – молярная масса вещества (г/моль);
ρ = m/V (плотность)
Wэлемента = (n * Ar (элемента) * 100%) / Mr (вещества),
где n – индекс, число атомов;
W – массовая доля элемента (%)
2. Разберите образец решения задачи
Углеводород содержит 81,82% углерода. Масса 1 л этого углеводорода (н.у.) составляет 1,964 г. Найдите молекулярную формулу этого углеводорода.
Решение:
1. Определим молярную массу искомого вещества:
ρ = m/V, следовательно М(СхНу) = ρ· Vm = 1,964 г/л · 22,4 л/моль = 44
2. По формуле: n = (Wэлемента * Mr(вещества)) / Ar элемента * 100%
вычислим число атомов C, H.
Здесь Мr=M
n(C)=(81,82% · 44) / (12 · 100%) = 3
n(H)=(18,18% · 44) / (1· 100%) = 8
Получаем x:y =3 : 8, следовательно, вещество C3H8
Проверка, Mr(C3H8)= 44
III. Определение формулы по продуктам сгорания
Разберите образец решения задачи
При сгорании 10,5 г органического вещества получили 16,8 л углекислого газа (н.у.) и 13,5 г воды. Плотность этого вещества при н.у. равна 1,875 г/л. Определите молекулярную формулу вещества.
Решение:
1. Находим молярную массу вещества и его количество вещества:
Если в условии задачи дана относительная плотность органического вещества, то его молекулярную массу определяем согласно формулам:
D(O2) = Mr(газа)/Mr(O2)=Mr(газа)/32;
D(H2) = Mr(газа)/Mr(H2)=Mr(газа)/2;
D(воздуха)=Mr(газа)/Mr(воздуха)=Mr(газа)/29.
M(вещества) = ρ· Vm = 1.875 г/л · 22,4 л/моль = 42 г/моль
υ(вещества ) = m / M = 10,5 г / 42 г/моль = 0,25 моль
2. Найдём количества вещества C, H по формулам:
υ = V/Vm или υ = m/M
υ(C) = υ(CO2)= V/Vm =16,8 л/22,4 л/моль=0,75 моль
υ(H) = 2 · υ(H2O) = 2 · m/M = (2 · 13,5 г)/18 г/моль = 1,5 моль
3. Определим наличие кислорода в формуле вещества:
m(C) = υ(C) · M(C) = 0,75 моль · 12 г/моль = 9 г
m(H) = υ(H) · M(H) = 1,5 моль · 1 г/моль = 1,5 г
m(O) = m(вещества) – (m(C) + m(H)) = 10.5 г – (9 г + 1,5 г) = 0 г, следовательно кислород отсутствует и это углеводород — CxHy
4. Находим формулу
υ(CxHy) : υ(С) : υ(Н) = 0,25 : 0,75 : 1,5 = 1 : 3 : 6
(здесь к целым числам пришли путём деления всех чисел на меньшее из них, т.е. на 0,25)
Следовательно, 1 моль вещества содержит 3 моль углерода и 6 моль водорода, таким образом, искомая формула С3Н6.
IV. Решите задачи
Задача №1. В углеводороде массовая доля углерода равна 84%. Относительная плотность паров углеводорода по воздуху равна 3,45. Определите формулу углеводорода.
Задача №2. Массовая доля углерода в углеводороде составляет 83,33%. Плотность паров углеводорода по водороду равна 36. Определите формулу.
Задача №3. Массовая доля углерода в углеводороде составляет 85,7%. Плотность паров углеводорода по воздуху равна 1,931. Определите формулу.
Задача №4. Углеводород содержит 16,28% водорода. Плотность этого вещества при нормальных условиях 3,839 г/л. Найдите молекулярную формулу этого углеводорода.
Задача №5. Углеводород содержит 82,76% углерода. Масса 1 л этого углеводорода (н.у.) составляет 2.589 г. Найдите молекулярную формулу этого углеводорода.
Задача №6. При сгорании вещества массой 4,25 г образовались оксид углерода (IV) массой 13,2 г и вода массой 5,85 г. Относительная плотность паров этого вещества по воздуху равна 5,862. Определите формулу вещества.
Цель: применение алгоритма при
решении задач на вывод формул.
Задачи:
- расширить знания учащихся о способах решения
задач; - закрепить навыки работы с алгоритмами;
- показать взаимосвязь химии и математики.
ХОД УРОКА
1. Оргмомент
Учитель знакомит класс с темой урока, целью и
задачами урока.
2. Повторение общих формул органических
веществ.
Учитель предлагает учащимся назвать общие
формулы алканов, алкенов, алкинов, циклоалканов,
алкадиенов, типы гибридицациии атомов углерода,
характерные изомерии для каждого класса.
3. Составление алгоритма для решения задач
на нахождение формулы вещества по продуктам
сгорания вещества, если дана относительная
плотность.
АЛГОРИТМ №1.
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов С:
а) если СО2 дано по массе:
n(C) =

(2)
б) если СО2 дано в объеме:
n(C) =

(3)
3. Вычисляем количество атомов Н:
Так как в молекуле Н2О 2 моля Н, тогда
формулу умножаем на 2 (это применимо и к N)
n(Н) = 2
(4)
4. Вычисляем молярную массу полученного
вещества.
5. Если молярная масса полученного вещества
равна молярной массе вещества (1), тогда задача
решена правильно; если молярная масса
полученного вещества отличается от молярной
массы вещества (1), вычисляем разность и
определяем количество атомов кислорода, если
вещество кислородосодержащие, или азота, если
вещество азотосодержащее.
Пример:
При сгорании органического вещества массой 2, 37
г образовалось 3,36 г оксида углерода(IV) (н.у.), 1,35
г воды и азот. Относительная плотность этого
вещества по воздуху равна 2,724. Выведите
молекулярную формулу вещества.
Дано:
m ( в-ва) = 2,37г
V (CO2) = 3,36 л
m (H2O) = 1,35 г
D (возд.) = 2,724.
_________________
Найти:
CxHyNz
М(возд) = 29 г/моль
М(Н2О) = 18 г/моль
Vm = 22,4л/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2,724 =79 г/моль.
Находим количество атомов С по формуле (3)
n(C) = = 5
2. Находим количество атомов Н по формуле (4)
n(Н) = 2 = 5
3. Вычисляем молярную массу С5Н5.
М(С5Н5) = 12 * 5 + 1 * 5 = 65г/моль
4. Вычисляем количество атомов азота (5)
79 – 65 = 14. т.к. атомная масса азота – 14, значит в
данной формулу один атом N.
Ответ: С5Н5N
4. Составление алгоритма нахождение
молекулярной формулы вещества по его
относительной плотности и массовой доле
элементов в соединении.
АЛГОРИТМ № 2
1. Вычисляем молярную массу вещества.
М(в) = D(x)*М(х) (1)
2. Вычисляем количество атомов элемента:
а) если w дана в процентах:
n(Э) =
(2)
б) если w дана в долях:
n(Э) =
(3)
3. Вычисляем молярную массу полученного
вещества.
4. Если молярная масса полученного вещества
равна молярной массе вещества (1), тогда задача
решена правильно; если молярная масса
полученного вещества отличается от молярной
массы вещества (1), вычисляем разность и
определяем количество атомов кислорода, если
вещество кислородосодержащие, или азота, если
вещество азотосодержащее.
Пример:
Выведите формулу вещества, содержащего 82,75%
углерода и 17,25 % водорода. Относительная
плотность паров этого вещества по воздуху равна
2.
Дано:
w(C) = 82,75%
w(H) = 17,25%
D(возд) = 2
______________
Найти:
СхНу
M(воздуха) = 29г/моль
М(С4Н10) =12 * 4 + 1 * 10 = 58г/моль
Решение:
1. Применяем формулу (1)
M(в-ва) = 29 г/моль * 2 =58 г/моль.
2. Находим количество атомов С по формуле (2)
n(С) = = 4
3. Находим количество атомов Н по формуле (2)
n(Н) = = 1
4. Вычисляем молярную массу С4Н10
М(С4Н10) = 12 * 4 + 1 * 10 = 58г/моль
5. Вычисленная молярная масса совпадает с (1),
задача решена.
Ответ: С4Н10
5. Закрепление материала
Учащиеся решают задачи самостоятельно, по
необходимости консультируются с учителем.
Задача 1. При сгорании 11,2 г.
Углеводорода получили оксид углерода массой 35,2 г
и воду массой 14,4 г. Относительная плотность этого
углеводорода по воздуху равна 1,93. Выведите
молекулярную формулу.
Задача 2. При сжигании 2.2 г. вещества
получили 4,4 г оксида углерода и 1,8 г. воды.
Относительная плотность вещества по водороду
равна 44. Определите молекулярную формулу
вещества.
Задача 3. Выведите формулу вещества,
содержащего 81,8% углерода и 18,2 % водорода, если
относительная плотность по водороду равна 22.
Задача 4. Определите молекулярную
формулу углеводорода, если массовая доля
углерода равна 85,75, а водорода –14,3%.
Относительная плотность этого вещества по азоту
примерно равна 2.
6. Домашнее задание
Гара Н.Н., Горбусева Н. И. Сборник задач. –
М.:Дрофа, 2010.
Задачи: 1.5; 1.17; 2.10; 2.27.
Определение формулы вещества
(углеводороды)-решение –задание 35
1. В
результате сплавления натриевой соли карбоновой кислоты с гидроксидом
натрия массой 14 г получили карбонат натрия и газообразное
органическое вещество массой 15,4 г. Определите молекулярную формулу
полученного газообразного соединения.
Пояснение.
Составим
уравнение реакции:
Определим
количество моль гидроксида натрия и углеводорода:
Установим
формулу углеводорода:
Молекулярная
формула пропана —
2. Для
полного гидрирования 4,6 г гомолога бензола потребовалось 3,36 л
(н. у.) водорода. Запишите уравнение реакции в общем виде. Определите
молекулярную формулу циклоалкана, образовавшегося при гидрировании.
Пояснение.
Элементы
ответа:
1) Составлено
уравнение реакции в общем виде:
2) Рассчитано
количество вещества водорода и гомолога бензола:
3) Определено
число атомов углерода в составе гомолога бензола, и установлена молекулярная
формула циклоалкана:
Молекулярная
формула циклоалкана —
3. При
сгорании 17,5 г органического вещества получили 28 л (н. у.)
углекислого газа и 22,5 мл воды. Плотность паров этого вещества
(н. у.) составляет 3,125 г/л. Известно также, что это вещество было
получено в результате дегидратации третичного спирта. На основании
данных условия задачи:
1) произведите
вычисления, необходимые для установления молекулярной формулы органического
вещества;
2) запишите
молекулярную формулу органического вещества;
3) составьте
структурную формулу исходного вещества, которая однозначно отражает
порядок связи атомов в его молекуле;
4) напишите
уравнение реакции получения данного вещества дегидратацией соответствующего
третичного спирта.
Пояснение.
1)
Найдено количество вещества продуктов сгорания:
Значит
никаких других элементов в состав вещества не входит, так как его масса равна
сумме масс водорода и углерода.
2)
Установлена молекулярная формула вещества: простейшая
формула —
это алкен или циклоалкан.
Так как
вещество может быть получено при дегидратации спирта, то это алкен.
Для
определения его молекулярной формулы напишем реакцию горения в общем виде
Вспомним,
что плотность паров этого вещества (н.у.) составляет 3,125 г/л.
Значит .
По
уравнению реакции
получаем, что
Молекулярная
формула соединения
3)
Учитывая, что вещество может быть получено из третичного спирта, получаем
структурную формулу вещества:
4)
Составлено уравнение реакции дегидратации:
4. Жидкий
при обычных условиях ацетиленовый углеводород массой 4,51 г может
полностью прореагировать с 440 г бромной воды с массовой долей брома
4 %. Углеводород взаимодействует с аммиачным раствором оксида
серебра, и в его составе есть четвертичный атом углерода. Установите молекулярную
формулу углеводорода, изобразите его структурную формулу и напишите
уравнение реакции с водой.
Пояснение.
1) Напишем
уравнение реакции в общем виде и вычислим количество вещества брома:
2) Установим
молекулярную формулу углеводорода:
Молекулярная
формула углеводорода —
3) Изобразим
структурную формулу.
Углеводород
взаимодействует с аммиачным раствором оксида серебра, следовательно
тройная связь находится на краю цепи. Структурная формула с четвертичным
атомом углерода:
4) Напишем
уравнение реакции с водой:
5. Смесь
цис- и транс-изомеров этиленового углеводорода общим объёмом 1,568 л (н.
у.) пропустили через избыток водного раствора перманганата калия, в результате
образовался двухатомный спирт массой 6,30 г. Установите молекулярную формулу
углеводорода, изобразите структурную формулу транс-изомера и напишите
уравнение его реакции с подкисленным раствором перманганата калия.
Пояснение.
1) Напишем
уравнение реакции в общем виде и вычислим:
общее количество вещества этиленового
углеводорода:
или
2) Установим
молекулярную формулу углеводорода:
Молекулярная
формула углеводорода —
3) Изобразим
структурную формулу.
Цис-транс-изомеры
есть только у бутена-2. Структура транс-изомера:
4) Напишем
уравнение окисления бутена-2 до уксусной кислоты:
6. При
полном сгорании 17,1 г жидкого углеводорода образовалось 26,88 л (н. у.)
углекислого газа. Известно, что при радикальном хлорировании углеводорода
образуется только одно монохлорпроизводное. Установите молекулярную формулу
углеводорода, изобразите его структурную формулу и напишите уравнение
реакции с хлором на свету.
Пояснение.
1) Напишем
уравнение реакции в общем виде:
2) Установим
молекулярную формулу углеводорода:
Молекулярная
формула углеводорода —
3) Изобразим
структурную формулу.
Все атомы
водорода в молекуле эквивалентны. Среди всех изомеров таким
свойством обладает только 2,2,3,3-тетраметилбутан:
4) Напишем
уравнение реакции с хлором на свету:
7. При
бромировании 28,8 г гомолога бензола в присутствии железа получено
35,82 г монобромпроизводного. Выход продукта составил 75 %. Известно, что
при бромировании этого углеводорода на свету образуется единственное
монобромпроизводное. Установите молекулярную формулу углеводорода,
изобразите его структурную формулу и напишите уравнение реакции с
бромом на свету.
Пояснение.
1) Напишем
уравнение реакции в общем виде:
2) Установим
молекулярную формулу углеводорода:
mтеор
Молекулярная
формула —
3) Изображена
структурная формула.
Так как
на свету образуется только одно монобромпроизводное, все атомы водорода
в боковых цепях эквивалентны. Это означает, что в боковых цепях есть только
метильные группы. Среди трёх триметилбензолов наиболее
симметричным является 1,3,5-триметилбензол:
4) Написано
уравнение реакции с бромом на свету:
8. При полной
гидратации 20,5 г ацетиленового углеводорода образовалось органическое
вещество массой 25,0 г. Определите молекулярную формулу углеводорода
и установите его структуру, если известно, что он реагирует с аммиачным
раствором оксида серебра, а в состав молекулы входят три метильные
группы. Напишите уравнение реакции этого углеводорода с избытком
хлороводорода.
Пояснение.
1) Напишем
уравнение с водой в общем виде.
CnH2n−2+H2O
→ CnH2nO
2) Составим
математическое выражение и определим молекулярную формулу углеводорода.
Молекулярная
формула —
3) Изобразим
структурную формулу.
Углеводород
реагирует с аммиачным раствором оксида серебра, следовательно, тройная
связь находится на краю цепи. Три метильные группы есть в молекуле
3,3-диметилбутина-1:
4) Напишем
уравнение реакции с избытком хлороводорода:
9. При действии
избытка водного раствора перманганата калия на 10,5 г этиленового
углеводорода образовалось органическое вещество массой 15,6 г. Определите
молекулярную формулу углеводорода и установите его структуру,
если известно, что в результате реакции с горячим подкисленным раствором
перманганата калия образуются кетон и углекислый газ. Напишите
уравнение гидратации этого углеводорода.
Пояснение.
1) Напишем
уравнение окисления в общем виде:
Допускается
также схема в виде
2) Составим
математическое выражение и определим молекулярную формулу
углеводорода.
Молекулярная
формула —
3) Изобразим
структурную формулу.
При окислении
углеводорода образуются кетон и углекислый газ, следовательно, двойная
связь находится при разветвлении цепи, с одной стороны, и с края цепи, с
другой стороны. Углеводород – 2-метилбутен-1.
4) Напишем
уравнение реакции с водой:
10. При
сгорании 4,48 л (н. у.) газообразного органического вещества получили 35,2
г углекислого газа и 10,8 г воды. Плотность этого вещества составляет 2,41 г/л
(н. у.). Известно также, что это вещество не реагирует с аммиачным
раствором оксида серебра, а при реакции его с избытком бромной воды происходит
присоединение атомов брома только ко вторичным атомам углерода.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для установления молекулярной формулы
органического вещества;
2)
запишите молекулярную формулу органического вещества;
3)
составьте структурную формулу исходного вещества, которая однозначно отражает
порядок связи атомов в его молекуле;
4) напишите
уравнение реакции этого вещества с избытком бромной воды.
Пояснение.
Общая
формула вещества —
1)
Найдены количество вещества углекислого газа, воды и органического вещества:
= 35,2
/ 44 = 0,8 моль
= 10,8
/ 18 = 0,6 моль
=
2,41 · 22, 4 = 54 г/моль
= 4,48
/ 22,4 = 0,2 моль
2)
Определена молекулярная формула вещества:
=
= 0,8
моль
=
= 1,2
моль
=
/
=
0,8 / 0,2 = 4
=
/
= 1,2
/ 0,2 = 6
4 · 12 +
6 + z · 16 = 54
= 0
Молекулярная
формула —
3)
Составлена структурная формула вещества:
4)
Составлено уравнение реакции этого вещества с избытком бромной воды:
11. При
сгорании 16,2 г органического вещества нециклического строения получили 26,88 л
(н. у.) углекислого газа и 16,2 г воды. Известно, что 1 моль этого
органического вещества в присутствии катализатора присоединяет только 1 моль
воды и данное вещество не реагирует с аммиачным раствором оксида серебра.
На
основании данных условия задачи:
1)
произведите вычисления, необходимые для установления молекулярной формулы
органического вещества;
2)
запишите молекулярную формулу органического вещества;
3)
составьте структурную формулу органического вещества, которая однозначно
отражает порядок связи атомов в его молекуле;
4)
напишите уравнение реакции гидратации органического вещества.
Пояснение.
Искомое
вещество — углеводород
Простейшая
формула
Возможные
молекулярные формулы:,
,
и
т.д. Условию, что 1 моль этого органического вещества в присутствии
катализатора присоединяет только 1 моль воды, соответствует только
формула ,
при условии, что это алкин, а не алкадиен (остальные могут присоединять большее
количество воды)
Молекулярная
формула: —
бутин
Вещество
не реагирует с аммиачным раствором оксида серебра, значит, тройная связь находится
не у крайнего атома углерода − бутин-2
Структурная
формула:
12. При нитровании 26,5 г гомолога бензола получено 30,2 г
мононитропроизводного. Выход продукта составил 80 %, других нитропроизводных
не образовалось. Установите молекулярную формулу углеводорода, изобразите
его структурную формулу и напишите уравнение реакции с хлором на
свету.
Пояснение.
1) Напишем уравнение реакции в общем виде:
2) Установим молекулярную формулу углеводорода:
mтеор
Молекулярная формула —
3) Изобразим структурную формулу.
Так как образуется только одно мононитропроизводное, все
атомы водорода в бензольном кольце эквивалентны. Среди всех изомеров таким
свойством обладает только 1,4-диметилбензол (пара-ксилол):
4) Напишем уравнение реакции с хлором на свету:
13. При сгорании 10,5 г органического вещества получили
16,8 л углекислого газа (н. у.) и 13,5 г воды. Плотность паров этого
вещества (н. у.) составляет 1,875 г/л.
Известно, что в результате присоединения хлороводорода
к этому веществу образуется только одно монохлорпроизводное.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления
молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического
вещества;
3) составьте структурную формулу этого вещества, которая
однозначно отражает порядок связи атомов в его молекуле;
4) напишите уравнение реакции этого вещества с
хлороводородом.
Пояснение.
1) Найдем количество вещества продуктов сгорания:
кислород отсутствует; вещество — углеводород
2) Установим молекулярную формулу вещества:
простейшая
формула
Значит, молекулярная формула вещества — .
3) Приведем структурную формулу вещества:
—
циклопропан или пропен. Циклопропан образует только одно хлоропроизводное в
реакции с хлороводородом:
4) Составим уравнение реакции вещества с хлороводородом:
14. При сжигании паров углеводорода было получено 20,16 л (н. у.)
углекислого газа и 7,2 г воды. При окислении углеводорода горячим подкисленным
раствором перманганата калия образуется терефталевая (бензол-1,4-дикарбоновая)
кислота. Определите молекулярную формулу углеводорода и установите его
структуру. Напишите уравнение описанной реакции с перманганатом калия.
Пояснение.
Вариант ответа:
1) Найдены количества углекислого газа и воды:
2) Определена молекулярная формула углеводорода.
Из условия следует, что углеводород – ароматический и содержит
одно бензольное кольцо, следовательно простейшая формула совпадает
с молекулярной формулой.
3) Изображена структурная формула.
До терефталевой кислоты окисляется ароматический углеводород,
имеющий две боковые цепи в пара-положении относительно друг друга. Подсчет
атомов водорода приводит к выводу о том, что в одной из цепей – тройная связь.
4) Написано уравнение реакции с перманганатом калия:
15. При гидратации 31,50 г этиленового углеводорода образовалось 23,76
г органического вещества. Выход продукта составил 60 %. Определите молекулярную
формулу углеводорода и установите его структуру, если известно, что при его
жёстком окислении перманганатом калия образуются кетон и кислота. Напишите
уравнение реакции углеводорода с водой, в уравнении изобразите структурные
формулы органических веществ.
Пояснение.
1) Написано уравнение реакции гидратации в общем виде:
2) Определена молекулярная формула углеводорода:
Молекулярная формула углеводорода —
(Возможен и другой способ вывода молекулярной формулы по массам
реагента и продукта)
3) Изображена структурная формула.
При окислении образуются кетон и кислота, следовательно углеродный
скелет разветвлённый, а двойная связь находится в середине цепи:
4) Написано уравнение реакции с водой:
Фреоны
Задача. В мастерской по ремонту холодильников и климатического оборудования отклеились этикетки от 5 баллонов с хранившимися в них фреонами (техническое название группы насыщенных алифатических галогенсодержащих углеводородов, применяемых в качестве хладагентов). Этикетки содержали следующие надписи: R-12, R-23, R-32, R-41, R-161. Для установления формул фреонов были проведены исследования. При сжигании фреона 1 образовалось 2,24 л СО2 и 4 г HF. Фреон 2 не горит (ω(C) = 9,92%; D(H2) = 60,5). У фреона 3 (ω(F) = 39,58%, ω(Н) = 10,42%). При взаимодействии фреона 4 с натрием образовался этан и фторид натрия. При щелочном гидролизе фреона 5 образовались две соли: формиат натрия (ω(C) = 17,65%; ω(О) = 47,06%) и фторид натрия. Установите структурные формулы указанных фреонов и дайте им химические названия, установите соответствие между кодом фреона и его формулой.
Данная задача предназначена для десятиклассников, которые еще не освоили курс кислородсодержащих органических соединений, поэтому даны массовые доли.
1. Начнем с фреона № 1. При его сжигании образовалось 2,24 л углекислого газа. Найдем количество углекислого газа. Делим его объем на молярный объем и получаем 0,1 моль. Соответственно, атомов углерода тоже 0,1 моль, поскольку в каждой молекуле углекислого газа содержится один атом углерода.
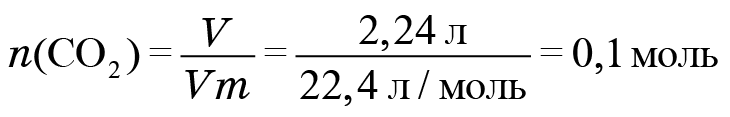
Информацию по водороду возьмем из фтороводорода. Найдем количество фтороводорода. Поскольку дана его масса, мы должны поделить массу (4 г) на молярную массу. Молекула фтороводорода состоит из атома фтора и атома водорода. Масса атома фтора 19, у водорода масса 1, значит, молярная масса 20. И мы получаем 0,2 моль.
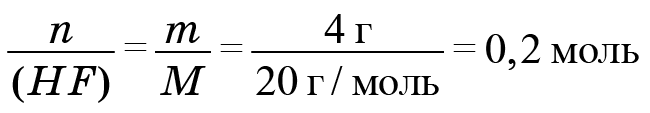
Следовательно, H = 0,2 и F = 0,2. Формула вещества, фреона № 1: CH2F2 (на один атом углерода приходится два атома водорода и два атома фтора).

2. Узнаем, что скрывается под фреоном № 2. Известно, что он не горит, и дана его плотность по водороду. Это относительная плотность, которая показывает, во сколько раз молярная масса вещества больше молярной массы (в данном случае) водорода. Молярная масса фреона № 2 равна 121 г/моль.
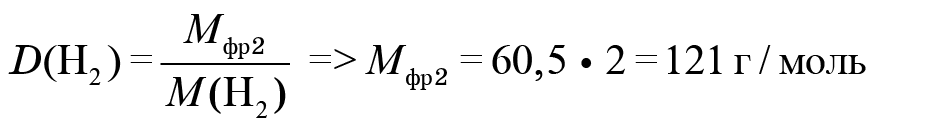
Сколько атомов углерода во фреоне № 2? Для подсчета используем массовую долю углерода. Масса углерода равна: молярную массу умножить на массовую долю. Получаем 12. Значит, в данной молекуле фреона № 2 содержится только один атом углерода.
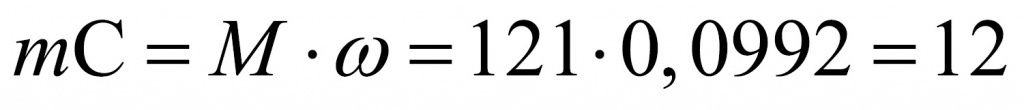
Нарисуем этот атом углерода. У него имеется четыре связи, поскольку в органической химии углерод четырехвалентный. Попробуем определить атомы, исходя из того, что в сумме один атом углерода и все остальные атомы должны равняться молярной массе (равной молекулярной) 121. Попробуем рассчитать. Если это четыре атома фтора, то получается мало. А если это четыре атома хлора, то много. Возьмем нечто среднее: половина — атомы фтора и половина — атомы хлора. Единица в показателе 121 говорит о том, что имеются нечетные значения. Молярная масса хлора 35,5. Для того чтобы получить целое численное значение, вероятно, нужны два атома хлора.
121 – 71 – 12 = 38 (ровно на два атома фтора)
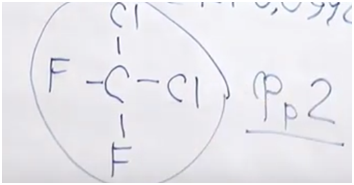
3. Перейдем к фреону № 3. Нам дана массовая доля фтора: 39,58. Дана массовая дола водорода: 10,42. Поскольку это органическое вещество, должен быть и углерод — попробуем его найти.
100 – 39,58 – 10,42 = 50
Проверим вариант, что там только хлор и нет других атомов. Предположим, что там всего один атом углерода (его масса будет равна 12). Посчитаем, какая масса при этом будет приходиться, например, на атом фтора.
12 ∙ 39,58 : 50 = 9,5
Как указано в периодической системе Менделеева, атомная масса фтора — 19. Ровно половина одного атома фтора — 9,5, так что в составе этой молекулы не может быть один атом углерода, их должно быть как минимум два. Следовательно, на углерод приходиться масса 24, на фтор — 19. Какая масса в данном случае приходится на водород? По сути, должно оставаться пять атомов водорода.
24 ∙ 10,42 : 50 = 5
Поскольку у нас один атом фтора, пять атомов водорода и два атома углерода, мы имеем дело с фторэтаном.

4. Что касается фреона № 4, то в реакции с натрием образовались этан и фторид натрия. Это реакция Вюрца — Фиттига. Мы имеем исходное вещество фторметан, которое реагирует с натрием, и образуются этан и фторид натрия.
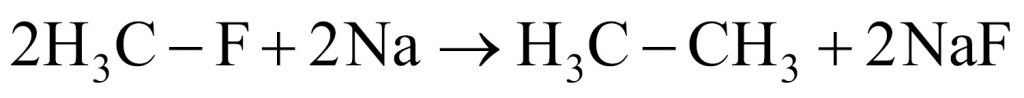
5. Переходим к фреону № 5. Формиат натрия образуется при гидролизе трифторметана. Получается формиат натрия, фторид натрия и две молекулы воды.
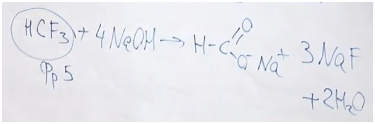
Посмотрев в справочную информацию, вы можете соотнести с кодами каждый из найденных фреонов.
Изучение фреонов очень интересно. Каждый тип холодильного оборудования требует особую марку фреона. Сегодня холодильное оборудование часто заполняют и углеводородами, поскольку, как известно, фреоны способствуют разрушению озонового слоя Земли. Но на сегодняшний день полного отказа от фреонов еще не произошло.

Химия. 10 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии, изложенный в учебниках «Химия. 8 класс» и «Химия. 9 класс» данного авторскогo коллектива. Предназначен для изучения химии на углубленном уровне. Учебник соответствует федеральному государственному образовательному стандарту среднего общeгo образования.
Купить
Вильгельм Рудольф Фиттиг
Задача. Вещество, открытое в 1862 году немецким ученым Вильгельмом Рудольфом Фиттигом, представляет собой бесцветные кристаллы (tпл = +690С). Они широко применяются в качестве пищевой добавки для сохранения товарного вида фруктов (например, цитрусовых) путем нанесения на кожуру плода. Для установления состава вещество массой 15,4 г сожгли, образовалось 26,88 л (н.у.) углекислого газа и 9 г воды. Установите структурную формулу, если известно, что оно может подвергаться каталитическому галогенированию. Составьте уравнение этого вещества с избытком водорода на платиновом катализаторе при повышенном давлении.
Похожую задачу часто можно встретить на ЕГЭ.
Начнем с определения молекулярной формулы вещества, то есть узнаем состав этой молекулы. Найдем количество углекислого газа, а оно равно количеству углерода. Разделим объем на молярный объем. Поскольку условия нормальные, молярный объем для газообразного вещества составляет около 22,4 л/моль.
26,88 л : 22,4 л/моль = 1,2 моль
Поскольку воды 9 г, а молярная масса воды 18 г, следовательно, воды 0,5 моль, а водорода 1 моль. Как такое может быть? В одной молекуле воды содержится целых два атома водорода. Но нам не сказано: соединение ли углеводородом? содержит ли кислород? Мы должны проверить наличие кислорода и найти массу углерода и водорода.
1,2 моль ∙ 12 = 14,4 г
Сумма углерода и водорода: 14,4 + 1 = 15,4. Следовательно, в составе неизвестного вещества нет кислорода.

Молярное соотношение показывает, что формула вещества С12H10. Почему не С6H5? Потому что в углеводородах никогда не бывает нечетного числа атомов водорода. Радикал С6H5 в химии называется фенилом. Иными словами, мы имеем соединение, которое называется в химии дифенил. На это также указывают химические свойства дифенила, и он является разрешенной пищевой добавкой. В магазинах можно встретить, например, апельсины, покрытые белым веществом — это и есть дифенил. Иногда его применяют в изрядном количестве, поэтому нужно тщательно мыть фрукты.
Составим уравнение реакции с избытком водорода. Очень просто посчитать, сколько атомов водорода потребуется на реакцию с дифенилом. Мы видим шесть двойных связей. Следовательно, на одну двойную связь нужна одна молекула водорода, а на шесть двойных связей — шесть молекул водорода при исчерпывающем гидрировании. Конечно, на platinum-катализаторе, потому что соединение ароматическое и требует преодоления достаточно высокого энергетического барьера. Мы получаем соединение, которое нельзя назвать никак иначе, кроме как дициклогексил.

Соединение дифенил и было открыто Рудольфом Фиттигом в 1862 году с температурой плавления 69°С.
Желеобразующая жидкость
Задача. Некоторая нерастворимая в воде жидкость при хранении на воздухе способна уплотняться, превращаясь в желе. Химик отобрал, отмерив, некоторый объем этой жидкости и установил, что при действии избытка раствора брома в четыреххлористом углероде образовалось 26,4 г дибромида. А при действии раствора хлора на такой же объем этой жидкости образовалось 17,5 г дихлорида. Определите структурную формулу этой жидкости, если известно, что в ее состав входят только атомы водорода и углерода. Составьте уравнение реакции полимеризации этой жидкости.
Обозначим неизвестную жидкость-углеводород через формулу CXHY. О какой реакции идет речь: замещения или присоединения? Поскольку реакция протекает при обычных условиях, значит, речь идет о реакции присоединения.
Для решения данной задачи нужно применить прием, известный в учебной химии как прием вычитания массы. Представим, что жидкости у нас ровно 1 моль. В этом случае разница между массой дибромида и дихлорида будет разницей между массой брома и хлора.
Молекула брома имеет массу 160, а молекула хлора — 71. Получаем 89. То есть если бы вещества у нас было 1 моль, то разница составила бы 89 г. Вычислим разницу массы дибромида и дихлорида:
26,4 – 17,5 = 8,9
Искомого вещества 0,1 моль.
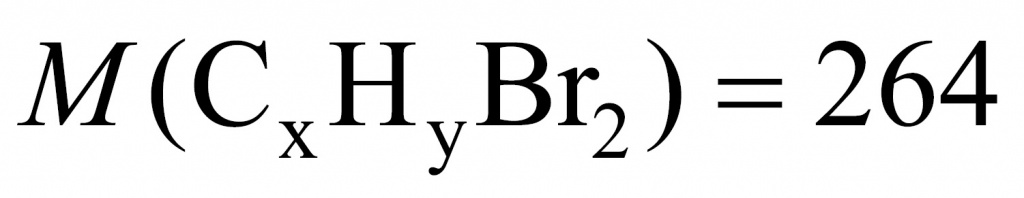
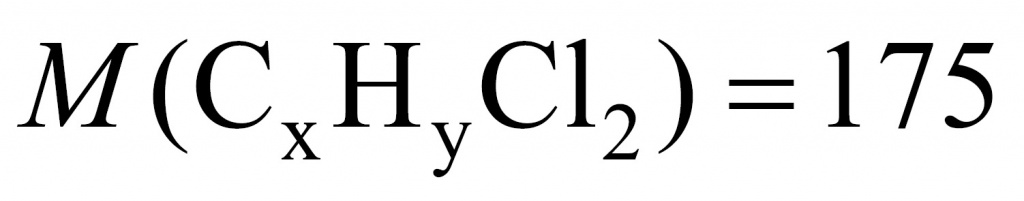
Теперь установим формулу. Обратимся к молекулярной записи. На углеводородную часть приходится 104. Сколько там может быть углеродов и водородов? Если углеродов 8 (что подходит), тогда на углероды приходится 96 и на водороды — 8.
Формула углеводорода C8H8.
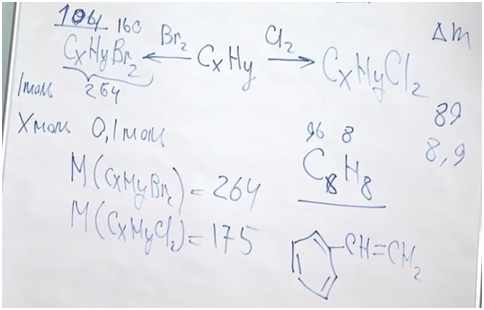
Разберемся, о каком углеводороде идет речь. Обратим внимание, что соединение непредельное, но оно способно присоединить только одну молекулу брома или одну молекулу хрома. Значит, исходя из малого числа атомов водорода по отношению к атомам углерода, скорее всего, это соединение есть не что иное, как производное бензола, то есть ароматическое соединение. В бензоле шесть атомов углерода и пять атомов водорода в остатке. У нас получается кетастирол.
Чтобы не было полимеризации, обычно в тот стирол, который можно купить в магазине, добавляют стабилизатор.
Уравнение полимеризации. Из n молекул стирола получается полимер, состоящий из n фрагментов.
Полистирол — это, например, одноразовая посуда. Она наносит существенный вред окружающей среде, и сейчас идет речь о том, чтобы ее запретить.
Отдушка для мыла
Задача. Некоторое легкоплавкое вещество, обладающее приятным запахом, используют в качестве ингибитора полимеризации, в качестве отдушки для мыла. При сжигании этого вещества массой 8,4 г получили 11,2 л (н.у.) углекислого газа, 7,2 г воды. Установите структурную формулу неизвестного соединения, если известно, что оно не реагирует с бромной водой, но реагирует с водородом в присутствии катализатора. Известно, что это соединение может быть получено в результате прокаливания кальциевой соли органической кислоты. Составьте уравнение соответствующей химической реакции.
По данным задачи, углекислый газ составляет 0,1 моль, соответственно, столько же и углерода. Поскольку воды 7,2 г, что в молях 0,4, то водорода 0,8. Проверим на наличие кислорода. Масса углерода 6, масса водорода – 0,8. Поскольку общая масса сожженного вещества составляет 8,4, то на кислород приходится масса 1,6 (в молях 0,1). Получается молекулярная формула C5H8O.

Перейдем к структурой формуле вещества. Вещество не реагирует с бромной водой — из этого можно делать вывод, что нет кратных соединений (то есть двойных, тройных углерод-углеродных связей). Но вещество реагирует с водородом в присутствии катализатора. Исходя из условий, скорее всего, речь идет о двухосновной кислоте. В результате прокаливания, нагревания (в пределах 200–250°С) отщепляется карбонат кальция и образуется кетон циклопентанон.
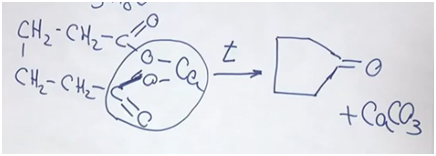
Циклопентанон как раз используют в качестве отдушки для мыла.
Ошибка А. М. Бутлерова
Задача. Установите структурную формулу альдегида, в определении которой немного ошибся великий А. М. Бутлеров, если известно, что в результате взаимодействия 100 г 0,9%-го раствора этого вещества с избытком раствора перманганата калия образуется осадок массой 3,48 г. Составьте уравнение реакции этого альдегида с раствором перманганата калия.
Все великие химики ошибались, в том числе и А. М. Бутлеров.
Для начала вспомним, как альдегиды взаимодействуют с перманганатом калия. Мы не знаем, о каком альдегиде идет речь. Допустим, у него была одна альдегидная группа (хотя, если в соединении две альдегидные группы, он все равно будет альдегидом). Возьмем также перманганат калия и мысленно нагреем. Мы получаем калиевую соль некой карбоновой кислоты, оксид марганца (IV) и гидроксид калия. Степень окисления углерода в альдегидной группе была +1, а стала +3. Получается, что углерод альдегид потерял два электрона. Марганец был +7, стал +4? значит, он принял три электрона. Так мы определили ключевые коэффициенты. Проблема состоит в том, что калия всего два атома. Можно сказать, что две молекулы были в форме соли, а одна молекула в форме кислоты. Поскольку гидроксида калия 3, мы видим, что его не хватает — вместо него будет вода.
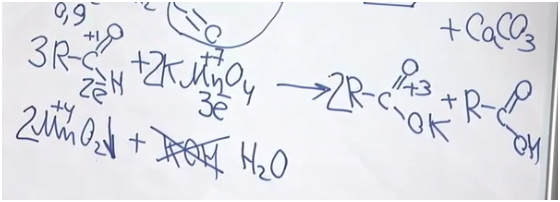
После составления уравнения найдем массу альдегида и массу осадка. Но осадок — это, разумеется, оксид марганца (IV).
Поскольку у нас 100 г 0,2%-го раствора и на 1% приходится 1 г, масса альдегида 0,9 г. Чтобы найти количество оксида марганца, 3,48 разделим на молярную масса оксида марганца — 87. Получаем 0,04 моль. В соответствии с этим уравнением альдегида у нас должно быть больше в полтора раза: 0,06 моль.
Найдем молярную массу альдегида.
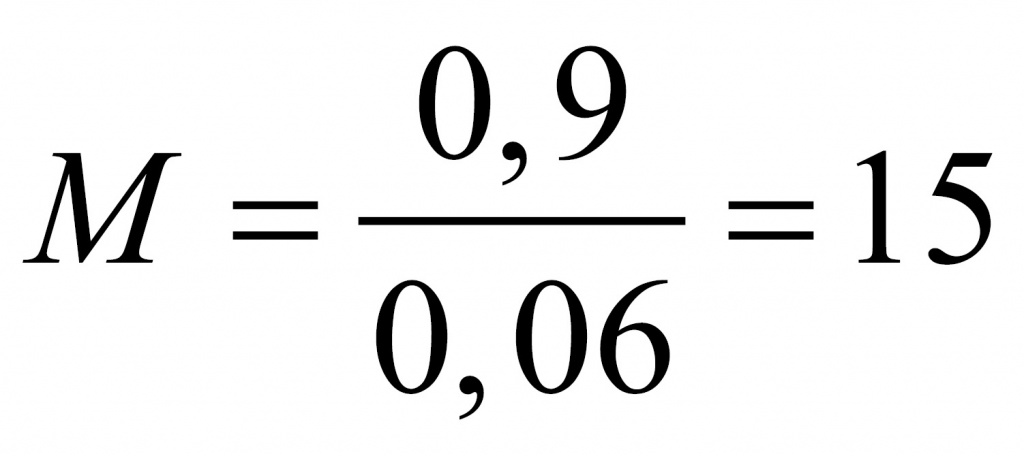
Где вы видели альдегид с молярной массой 15? Только на атом кислорода приходится 16. Значит, что либо альдегид содержал две альдегидные группы, либо это был формальдегид. Если бы он содержал две альдегидные группы, он бы отдал не два, а четыре электрона. Столько же отдал бы и формальдегид. Перманганат калия принимал бы три электрона. У оксида марганца (IV) было бы 4 моль. В этом случае оксида марганца 0,4 моль, а альдегида 0,3 моль.

Тогда
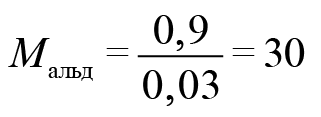
Следовательно, искомый альдегид — формальдегид. CH2O.
А. М. Бутлеров изначально определил формулу как C2H4O2.

Химия. 11 класс. Углубленный уровень. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова и продолжает курс химии для старшей школы, изложенный в учебнике «Химия. Углубленный уровень. 10 класс» данного авторского коллектива. Учебник предназначен для изучения химии на углублённом уровне. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
…ловая кислота
Задача. На полке в химической лаборатории стояла склянка с полустертой надписью. Единственное, что можно было разобрать: «…ловая кислота». Для установления состава кислоты провели ряд экспериментов. Для полной нейтрализации раствора, содержащего 0,36 г этой кислоты, понадобилось 50 мл 0,1-молярного раствора гидроксида натрия. Такая же навеска кислоты смогла обесцветить V = 80 мл (ω = 1%, ρ ≈ 1 г/мл) бромной воды. Восстановите надпись на склянке.
Обозначим формулу кислоты (будем считать, что она монокарбоновая). Если она одноосновная, то реакция идет один к одному. Найдем количество гидроксида натрия: 50 миллилитров 0,1-молярного раствора. У нас раствор, в одном литре которого содержится 0,1 моль вещества. Поскольку 50 мл — это в 20 раз меньше, то 0,1 разделим на 20. Получаем 0,005 гидроксида натрия. Столько же и карбоновой кислоты.
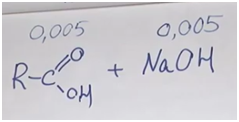
Отсюда легко находим молекулярную массу карбоновой кислоты.
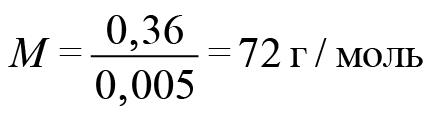
На карбоксильную группу приходится 45. Значит, на углеводородную часть приходится 27. В них поместятся два атома углерода и три атома водорода. Искомая кислота — акриловая.
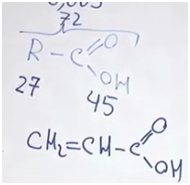
Электроны
Задача. 0,800000 кг вещества содержит 0,2743 г электронов. Установите формулу вещества, если известно, что масса электрона равна 0,0005486 а.е.м.
Начнем с количества электронов. Масса электронов у нас известна и молярная масса тоже.
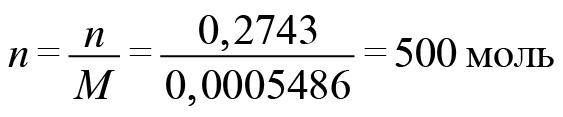
Число протонов равно количеству электронов:
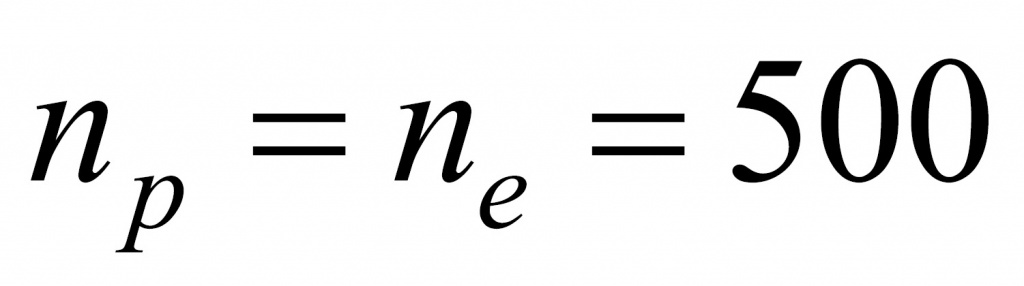
Отсюда находим массу, которая приходится на нейтроны (поскольку с точки зрения школьной химии любое число состоит из протонов, нейтронов и электронов). Обычно мы пренебрегаем массой электронов, но в данной задаче ей пренебрегать не нужно.
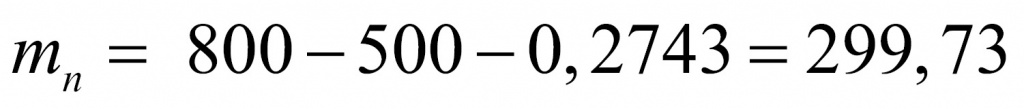
Получается интересное вещество. Обычно в атомах число нейтронов либо равно числу протонов, либо больше. В данном веществе протоны преобладают. Скорее всего, мы имеем дело с водородным соединением. Найдем соотношение между числом протонов и числом нейтронов.
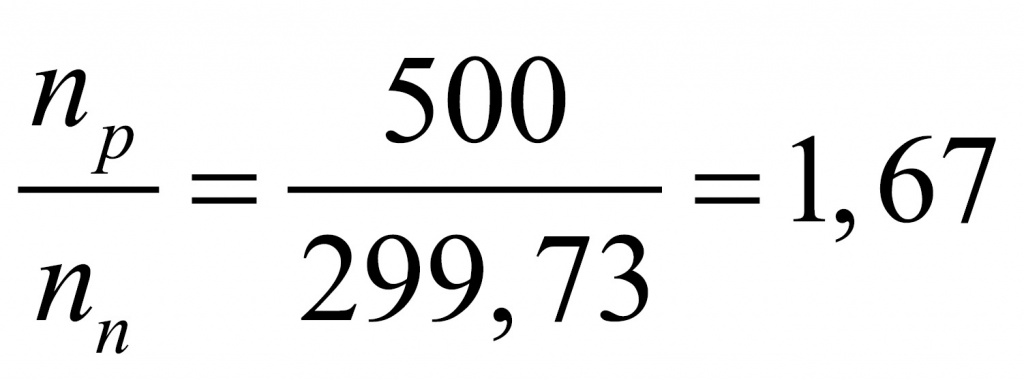
Если мы переберем водородные соединения элементов второго периода, то для метана получим, что в составе метана протонов буде 10, а нейтронов — 6.
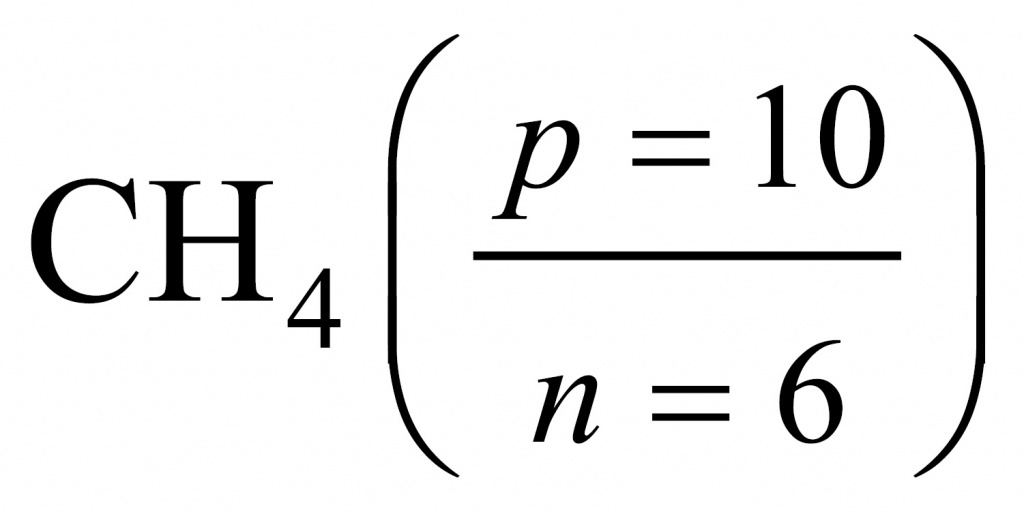
Поделив 10 на 6, получаем 1,67. Следовательно, искомым соединением был родоначальник предельных углеводородов, первый член гомологического ряда — метан.
#ADVERTISING_INSERT#