Загрузить PDF
Загрузить PDF
Энергия связи является важным понятием в химии. Она определяет количество энергии, которое необходимо для разрыва ковалентной связи между двумя атомами газа.[1]
Данное понятие неприменимо по отношению к ионным связям.[2]
Когда два атома соединяются в молекулу, можно определить, насколько крепка связь между ними — достаточно найти энергию, которую необходимо затратить для разрыва этой связи. Помните, что единичный атом не обладает энергией связи, эта энергия характеризует силу связи двух атомов в молекуле. Чтобы рассчитать энергию связи для какой-либо химической реакции, просто определите общее количество разорванных связей и вычтите из него количество образовавшихся связей.
-
1
Запишите уравнение для вычисления энергии связи. Согласно определению, энергия связи представляет собой сумму разорванных связей за вычетом суммы сформированных связей: ΔH = ∑H(разорванные связи) — ∑H(образовавшиеся связи). ΔH обозначает изменение энергии связи, которое называют также энтальпией связи, а ∑H соответствует сумме энергий связи для обеих частей уравнения химической реакции.[3]
- Данное равенство выражает закон Гесса.
- Энергия связи измеряется в килоджоулях на моль (кДж/моль).[4]
-
2
Запишите химическое уравнение и обозначьте все связи между отдельными элементами. Если дано уравнение реакции в виде химических символов и цифр, полезно переписать его и обозначить все связи между атомами. Такая наглядная запись позволит вам легко посчитать связи, которые разрываются и образуются в ходе данной реакции.
- Помните, что в левой части уравнения расположены реагенты, а в правой — продукты реакции.
- Одинарные, двойные и тройные связи обладают разной энергией, поэтому будьте внимательны и правильно обозначайте связи между различными элементами.[5]
- К примеру, рассмотрим следующую реакцию: H2(газ) + Br2(газ) —> 2 HBr(газ)
- H-H + Br-Br —> 2 H-Br
-
3
Изучите правила подсчета разорванных и образовавшихся связей. В большинстве случаев при расчетах используются средние значения энергии связи.[6]
Одна и та же связь может иметь немного разную энергию, в зависимости от конкретной молекулы, поэтому обычно используют средние значения энергии связи.[7]
.- Разрывы одинарной, двойной и тройной химической связи рассматриваются как одна разорванная связь. Хотя эти связи обладают разными энергиями, в каждом случае считается, что разрывается одна связь.
- То же самое относится и к образованию одинарной, двойной или тройной связи. Каждый такой случай рассматривается как формирование одной новой связи.
- В нашем примере все связи являются одинарными.
-
4
Определите, какие связи разрываются в левой части уравнения. Левая часть химического уравнения содержит реагирующие вещества, и в ней представлены все связи, которые разрываются в результате реакции. Это эндотермический процесс, то есть для разрыва химических связей необходимо затратить определенную энергию.[8]
- К нашем примере левая часть уравнения реакции содержит одну связь H-H и одну связь Br-Br.
-
5
Подсчитайте количество образовавшихся связей в правой части уравнения. Справа указаны продукты реакции. В этой части уравнения представлены все связи, которые образуются в результате химической реакции. Это экзотермический процесс, и он протекает с выделением энергии (обычно в виде тепла).[9]
- В нашем примере в правой части уравнения содержатся две связи H-Br.
Реклама
-
1
Найдите необходимые значения энергии связи. Есть множество таблиц, в которых приведены значения энергии связи для самых разных соединений. Такие таблицы можно найти в интернете или справочнике по химии. Следует помнить, что значения энергии связи всегда приводятся для молекул в газообразном состоянии.[10]
- Для нашего примера необходимо найти значения энергии связей H-H, Br-Br и H-Br.
- H-H = 436 кДж/моль; Br-Br = 193 кДж/моль; H-Br = 366 кДж/моль.[11]
- Чтобы вычислить энергию связи для молекул в жидком состоянии, необходимо также найти энтальпию испарения данной жидкости. Это количество энергии, которое необходимо для перевода вещества из жидкого в газообразное состояние.[12]
Данное значение прибавляется к общей энергии связи.- Например, в случае воды необходимо добавить в уравнение энтальпию испарения воды (+41 кДж).[13]
- Например, в случае воды необходимо добавить в уравнение энтальпию испарения воды (+41 кДж).[13]
-
2
Умножьте значения энергии связи на число разорванных связей. В ряде реакций одна связь может разрываться несколько раз.[14]
Например, если молекула состоит из 4 атомов водорода, то энергию связи водорода следует учесть 4 раза, то есть умножить на 4.- В нашем примере каждая молекула имеет по одной связи, поэтому значения энергии связи просто умножаются на 1.
- H-H = 436 x 1 = 436 кДж/моль
- Br-Br = 193 x 1 = 193 кДж/моль
-
3
Сложите все энергии разорванных связей. После того как вы умножите значения энергий связи на соответствующее количество связей в левой части уравнения, необходимо найти общую сумму.[15]
- Найдем суммарную энергию разорванных связей для нашего примера: H-H + Br-Br = 436 + 193 = 629 кДж/моль.
-
4
Умножьте значения энергии связи на количество образовавшихся связей. Как и в случае с разорванными связями в левой части уравнения, следует взять значения энергий связи в правой части уравнения и умножить их на соответствующее число этих связей.[16]
Например, если образуется четыре связи между атомами водорода, необходимо умножить энергию данной связи на 4.- В нашем примере образуется две связи H-Br, поэтому энергию связи H-Br (366 кДж/моль) следует умножить на 2: 366 x 2 = 732 кДж/моль.
-
5
Сложите все энергии образовавшихся связей. Как и в случае разорванных связей, следует сложить все энергии образовавшихся связей, которые представлены в правой части уравнения.[17]
Если в результате реакции образуется лишь одно вещество, данный шаг можно пропустить.- В нашем примере образуется одно вещество, поэтому энергия сформировавшихся связей равна удвоенной энергии связи H-Br, то есть 732 кДж/моль.
-
6
Вычтите энергию образовавшихся связей из энергии разорванных связей. После того как вы сложите все связи в левой и правой частях уравнения, просто отнимите от разорванных связей образовавшиеся связи. Вспомните приведенное выше уравнение: ΔH = ∑H(разорванные связи) — ∑H(образовавшиеся связи). Подставьте вычисленные значения и найдите разность.
- Для нашего примера имеем: ΔH = ∑H(разорванные связи) — ∑H(образовавшиеся связи) = 629 кДж/моль — 732 кДж/моль = -103 кДж/моль.
-
7
Определите, является ли реакция эндотермической или экзотермической. Последний шаг при вычислении энергии связи состоит в том, чтобы выяснить, поглощается или выделяется энергия в ходе данной реакции. При эндотермических реакциях энергия поглощается, и итоговая энергия связи имеет положительное значение, в то время как при экзотермических реакциях энергия выделяется, и энергия связи принимает отрицательные значения.[18]
- В нашем примере общая энергия связи отрицательна, то есть рассмотренная реакция является экзотермической.
Реклама
Об этой статье
Эту страницу просматривали 26 439 раз.
Была ли эта статья полезной?
Download Article
Download Article
Bond energy is an important concept in chemistry that defines the amount of energy needed to break a bond between a covalently bound gas.[1]
This type of bond energy does not apply to ionic bonds. When 2 atoms bind together to form a new molecule, it is possible to determine how strong the bond between atoms is by measuring the amount of energy needed to break that bond. Remember, a single atom does not have a bond energy; it is the bond between 2 atoms that has energy. To calculate the bond energy of a reaction, simply determine the total number of bonds broken and then subtract the total number of bonds formed.
-
1
Define the equation for calculating bond energy. Bond energy is defined by the sum of all of the bonds broken minus the sum of all of the bonds formed: ΔH = ∑H(bonds broken) — ∑H(bonds formed). ΔH is the change in bond energy, also referred to as the bond enthalpy and ∑H is the sum of the bond energies for each side of the equation.[2]
- This equation is a form of Hess’s Law.
- The unit for bond energy is kilojoules per mol or kJ/mol.[3]
-
2
Draw the chemical equation showing all of the bonds between molecules. When given a reaction equation simply written with chemical symbols and numbers, it is helpful to draw this equation out, illustrating all of the bonds formed between the various elements and molecules. This visual representation will allow you to easily count all of the bonds that break and form on the reactant and product sides of the equation.
- Remember, the left side of the equation is all of the reactants and the right side is all of the products.
- Single, double, and triple bonds have different bond energies, so be sure to draw your diagram with the correct bonds between elements.[4]
- For example, if you were to draw out the following equation for a reaction between 2 hydrogen and 2 bromine: H2(g) + Br2(g) —> 2 HBr(g), you would get: H-H + Br-Br —> 2 H-Br. The hyphens represent single bonds between the elements in the reactants and the products.
Advertisement
-
3
Know the rules for counting broken and formed bonds. In most cases, the bond energies you will be using for these calculations will be averages.[5]
The same bond can have a slightly different bond energy based on the molecule it is formed in; therefore, average bond energies are generally used.[6]
- A single, double, and triple bond are all treated as 1 break. They all have different bond energies, but count as only a single break.
- The same is true for the formation of a single, double, or triple bond. It will be counted as single formation.
- For our example, all of the bonds are single bonds.
-
4
Identify the bonds broken on the left side of the equation. The left side contains the reactants. These will represent all of the broken bonds in the equation. This is an endothermic process that requires the absorption of energy to break the bonds.[7]
- For our example, the left side has 1 H-H bond and 1 Br-Br bond.
-
5
Count the bonds formed on the right side of the equation. The right side contains all of the products. These are all of the bonds that will be formed. This is an exothermic process that releases energy, usually in the form of heat.[8]
- For our example, the right side has 2 H-Br bonds.
Advertisement
-
1
Look up the bond energies of the bonds in question. There are many tables that have information on the average bond energies for a specific bond. These tables can be found online or in a chemistry book. It is important to note that these bond energies are always for molecules in a gaseous state.[9]
- For our example, you need to find the bond energy for an H-H bond, a Br-Br bond, and an H-Br bond.
- H-H = 436 kJ/mol; Br-Br = 193 kJ/mol; H-Br = 366 kJ/mol.
- To calculate bond energy for molecules in a liquid state, you need to also look up the enthalpy change of vaporization for the liquid molecule. This is the amount of energy needed to convert the liquid into a gas.[10]
This number is added to the total bond energy.- For example: If you were given liquid water, you would need to add the enthalpy change of vaporization of water (+41 kJ) to the equation.[11]
- For example: If you were given liquid water, you would need to add the enthalpy change of vaporization of water (+41 kJ) to the equation.[11]
-
2
Multiply the bond energies by the number of bonds broken. In some equations, you may have the same bond broken multiple times.[12]
For example, if 4 atoms of hydrogen are in the molecule, then the bond energy of hydrogen must be counted 4 times, or multiplied by 4.- In our example, there is only 1 bond of each molecule, so the bond energies are simply multiplied by 1.
- H-H = 436 x 1 = 436 kJ/mol
- Br-Br = 193 x 1 = 193 kJ/mol
-
3
Add up all of the bond energies of the broken bonds. Once you have multiplied the bond energies by the number of the individual bonds, you need to then sum all of the bonds on the reactant side.[13]
- For our example, the sum of the bonds broken is H-H + Br-Br = 436 + 193 = 629 kJ/mol.
-
4
Multiply the bond energies by the number of bonds formed. Just as you did for the bonds broken on the reactant side, you will multiply the number of bonds formed by its respective bond energy.[14]
If you have 4 hydrogen bonds formed, you would need to multiply that bond energy by 4.- For our example we have 2 H-Br bonds formed, so the bond energy of H-Br (366 kJ/mol) will be multiplied by 2: 366 x 2 = 732 kJ/mol.
-
5
Add up all of the formed bond energies. Again, like you did with the bonds broken, you will add up all of the bonds formed on the product side.[15]
Sometimes you will only have 1 product formed and can skip this step.- In our example, there is only 1 product formed, so the energy of the bonds formed is simply the energy of the 2 H-Br bonds or 732 kJ/mol.
-
6
Subtract the formed bonds from the broken bonds. Once you have summed all of the bond energies for both sides, simply subtract the formed bonds from the broken bonds. Remember the equation: ΔH = ∑H(bonds broken) — ∑H(bonds formed). Plug in the calculated values and subtract.[16]
- For our example: ΔH = ∑H(bonds broken) — ∑H(bonds formed) = 629 kJ/mol — 732 kJ/mol = -103 kJ/mol.
-
7
Determine whether the entire reaction was endothermic or exothermic. The final step to calculating bond energy is to determine whether the reaction releases energy or consumes energy. An endothermic (one that consumes energy) will have a final bond energy that is positive, while an exothermic reaction (one that releases energy) will have a negative bond energy.[17]
- In our example, the final bond energy is negative, therefore, the reaction is exothermic.
Advertisement
Add New Question
-
Question
What is c-h, c-cl bond energy?
c-cl 339, c-h 413.
-
Question
How do I calculate energy released?
Energy released (exothermic reaction, when bonds are forming) is just the enthalpy of bond formation. So it is just ∑H(bonds formed).
-
Question
What is the bond energy of a water molecule?
There are two O-H bonds in water, each having about 463 kJ. 463(2) = about 1852 kJ.
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
References
About This Article
Article SummaryX
To calculate bond energy, start by looking up the bond energies you’re working with either online or in a chemistry book. Then, multiply those bond energies by the number of individual bonds being broken, then add up all the energies on the reactant side of the equation. Next, repeat the process on the other side, multiplying the bond energies by the number of bonds formed and adding them up. Finally, subtract the formed bonds from the broken bonds to get the bond energy. If your answer is positive, the bond is endothermic, and if your answer is negative, the bond is exothermic. For tips on calculating the bond energy for liquid molecules, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 239,672 times.
Reader Success Stories
-
«This article really helped me get a better understanding and helped me pass my class.»
Did this article help you?
Home
/ Учебник ОБЩАЯ ХИМИЯ / Глава 4. Химическая связь / Энергия химической связи
Энергия химической связи

С точки зрения выигрыша в энергии, образование связи — это нечто вроде промежуточного процесса между присоединением электрона к нейтральному атому (измеренное сродство к электрону) и присоединением электрона к атому, заряд ядра которого увеличивается на 1 единицу.
Чтобы оценить энергию химической связи молекул, состоящих из многоэлектронных атомов, необходимо оценить:
- энергию связи связывающих электронов с ядрами,
- заряд ядра многоэлектронного атома,
- энергию межэлектронного отталкивания связывающих электронов от всех остальных электронов в молекуле.
Соотношение между энергией ионизации и зарядом ядра можно выразить следующим образом (см. раздел о энергии химической связи в атоме водорода):
EionZ = EionH Z2 , (4.3-1)
где EionZ и EionH — это энергия ионизации у водородоподобного атома и у атома с зарядом Z.
В случае с многоэлектронными атомами, значения зарядов ядер, используемые при вычислениях, не являются действительными зарядами ядер этих атомов. В таких вычислениях следует использовать так называемые эффективные заряды ядер (положительные заряды, которые действуют на связывающую электронную пару).
Аналогично уравнению (4.3-1), значение энергии межъядерного отталкивания, необходимое для оценки энергии молекулы, может быть также оценено с использованием эффективного заряда ядра с помощью выражения:
Erep eff = ErepH2 Zeff1 · Zeff2, (4.3-2)
где Erep eff — это эффективная энергия межъядерного отталкивания в молекуле, состоящей из двух атомов; ErepH2 — энергия отталкивания у молекулы H2; Zeff1 и Zeff2 — эффективные заряды ядер первого и второго атомов с учетом межядерного отталкивания.
Мы рассчитали энергию химической связи двухатомных молекул, состоящих из атомов и нескольких электронов как одноэлектронных атомов или водородоподобных атомов с зарядом ядра, равным эффективному заряду ядра этих молекул.
Для определения изменения электронной энергии при образовании молекулы из однотипных атомов, также как в случае с молекулой водорода, мы вычитаем энергию двух атомов от энергии молекулы и получаем, что эта энергия равна энергии связи в молекуле.
Рассмотрим раскладку сил в молекуле >>
Теперь мы можем вернуться объяснению энергии связи для группы D таблицы 4.4. >>
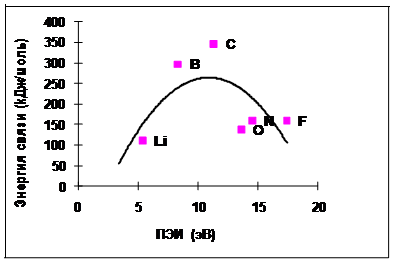
Рис. 4.3-2 Экспериментальные данные по зависимости энергии химической связи в молекуле Х-Х от ПЭИ атома Х для элементов второго периода
На рис. 4.3-2 и 4.3-3 показана зависимость энергии химической связи от ПЭИ атомов, составляющих эти молекулы.
Рис.4.3-3 Зависимость энергии химической связи в молекуле Х-Х от ПЭИ атома Х для элементов третьего периода (расчетные данные и экспериментальные).
Предполагалось, что энергия химической связи и ПЭИ (обе определяемые электростатическим взаимодействием) коррелируют между собой. Однако, расчетная зависимость энергии имеет форму параболы. То есть, когда ПЭИ увеличивается с 5 до 11 эВ [от лития (Li) к углероду (C)], увеличивается энергия химической связи, а при дальнейшем увеличении ПЭИ с 11 до 20 эВ, энергия связи уменьшается.
Согласно экспериментальным данным, энергия связи атомов также увеличивается на интервале с 5 до 11 эВ, но при дальнейшем увеличении ПЭИ от 11 до 16 падает до 0.
Очередное совпадение экспериментальной и расчетной зависимостей говорит о корректности объяснений природы химической связи.
Принципы образования связи в многоэлектронных атомах >>
Потенциал ионизации и энергия связи в двухатомных молекулах >>
Энергия химической связи
Длина связи >>
G-теория химической связи >>
Правило валентности >>
Донорно-акцепторная связь >>
Ван-дер-ваальсовая связь >>
Изомеризация. Динамическая связь >>
Основы стереохимии >>
Энергия связи
Важное значение
имеет энергетическая характеристика
химической связи. При образовании
химической связи общая энергия системы
(молекулы) меньше энергии составных
частей (атомов), т.е. Е(AB)<Е(А)+Е(B).
Энергия связи
– это энергия, которая выделяется при
образовании молекулы из атомов. Энергию
связи обычно выражают в кДж/моль (или
ккал/моль). Это одна из важнейших
характеристик химической связи. Более
устойчива та система, которая содержит
меньше энергии. Известно, например, что
атомы водорода стремятся объединиться
в молекулу. Это означает, что система,
состоящая из молекул Н2содержит
меньше энергии, чем система, состоящая
из такого же числа атомов Н, но не
объединенных в молекулы.
Для
двухатомных молекул энергия связи равна
энергии диссоциации. Для многоатомных
молекул с одним типом связи средняя
энергия связи равна 1/n
части распада молекулы на атомы. Энергия
распада метана на атомы равна 1649 кДж/моль.
В молекуле метана имеются четыре
равноценные связи С-Н поэтому средняя
энергия такой связи равна Ес-н = 1649/4 =
412 кДж/моль. оль.
Таблица
3 Длина
и энергия разрыва связей
|
d |
E |
d |
E |
||
|
C-H |
109 |
416 |
C=O |
116 |
695 |
|
C-F |
138 |
485 |
O-H |
96 |
467 |
|
C-Cl |
176 |
327 |
O-O |
148 |
146 |
|
C-Br |
194 |
285 |
S-H |
135 |
347 |
|
C-I |
214 |
213 |
N-H |
101 |
391 |
|
C-C |
154 |
356 |
As-H |
152 |
247 |
|
C=C |
134 |
528 |
|||
|
C≡C |
813 |
При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
Таблица
3 показывает:
а)закономерное
изменение энергии для однотипных
связей(C-F>C-Cl>C-Br>C-I),
Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
Металлическая связьвозникает в
результате частичной делокализации
валентных электронов, которые достаточно
свободно движутся в решетке металлов,
электростатически взаимодействуя с
положительно заряженными ионами. Силы
связи не локализованы и не направлены,
а делокализированные электроны
обусловливают высокую тепло- и
электропроводность.
Химическая
связь в твердых телах.Свойства
твердых веществ определяются природой
частиц, занимающих узлы кристаллической
решетки и типом взаимодействия между
ними.
Твердые
аргон и метан образуют атомные и
молекулярные кристаллы соответственно.
Поскольку силы между атомами и молекулами
в этих решетках относятся к типу слабых
ван-дер-ваальсовых, такие вещества
плавятся при довольно низких температурах.
Большая часть веществ, которые при
комнатной температуре находятся в
жидком и газообразном состоянии, при
низких температурах образуют молекулярные
кристаллы.
Температуры плавления ионных кристаллов
выше, чем атомных и молекулярных,
поскольку электростатические силы,
действующие между ионами, намного
превышают слабые ван-дер-ваальсовы
силы. Ионные соединения более твердые
и хрупкие. Такие кристаллы образуются
элементами с сильно различающимися
электроотрицательностями (например,
галогениды щелочных металлов). Ионные
кристаллы, содержащие многоатомные
ионы, имеют более низкие температуры
плавления; так для NaCl tпл.= 801 °C,
а для NaNO3tпл= 306,5 °C.
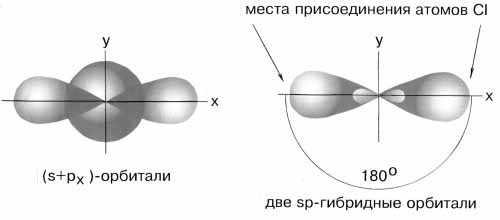
Пример
1.Каким типом гибридизации АО бериллия
описывается образование молекулы
хлорида бериллия? Какова конфигурация
этой молекулы?
Решение:
Возбужденный
атом бериллия имеет конфигурацию 2s12p1.
Поэтому можно считать, что в образовании
химических связей могут участвовать
не одинаковые, а различные атомные
орбитали. В молекуле BeCl2должны
быть неравноценные по прочности и
направлению связи, причем σ-связи из
p-орбиталей должны быть более прочными,
чем связи из s-орбиталей, т.к. для
p-орбиталей имеются более благоприятные
условия для перекрывания. Однако опыт
показывает, что в молекулах, содержащих
центральные атомы с различными валентными
орбиталями (s, p, d), все связи равноценны
– это объясняет метод гибридизации. В
данном случае имеет местоsp-
гибридизация
При
образовании молекулы одна s- и одна
р-орбиталь образуют две гибридные
sp-орбитали под углом 180о.
sp-гибридные орбитали
Экспериментальные
данные показывают, что все галогениды
Be, а также Zn, Cd и Hg (II) линейны и обе связи
имеют одинаковую длину.
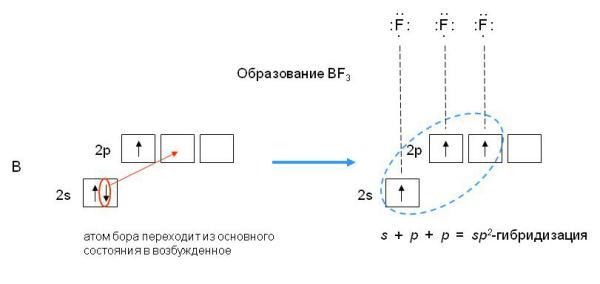
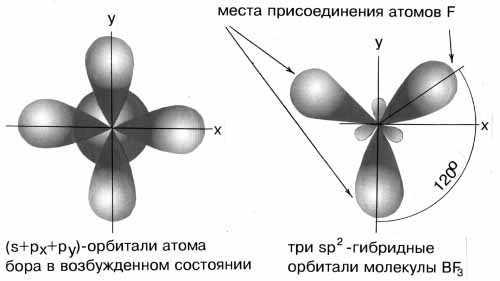
Пример
2. Определите тип гибридизации орбиталей
центрального атома в молекулеBF3.
Какова конфигурация этой молекулы?
Решение:
Возбуждённый
атом бора имеет конфигурацию 2s12p2.
В результате
гибридизации одной s-орбитали и двух
p-орбиталей образуются три гибридные
sp2-орбитали, расположенные в одной
плоскости под углом 120одруг к
другу.
sp2-гибридизация
Пример
3. Каким типом гибридизации АО азота
описывается образование молекулы
аммиака?
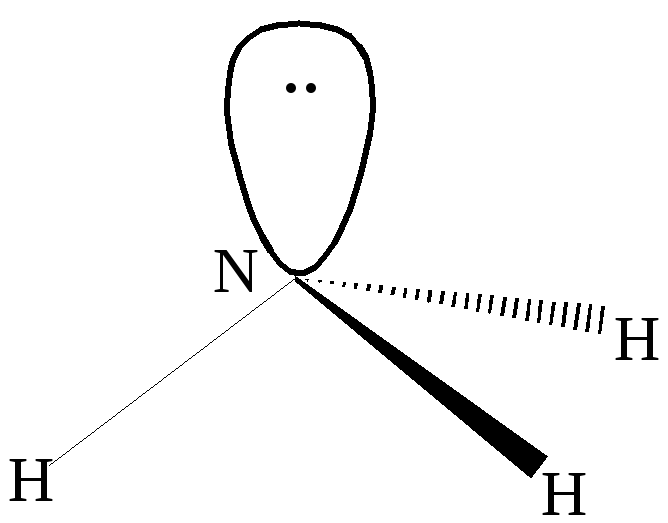
Решение:
В результате
гибридизации 2sи трёх 2pорбиталей азота образуются четыре
гибридные орбиталиsp
3 . Конфигурация молекулы
представляет из себя искажённый тетраэдр,
в котором три гибридных орбитали
участвуют в образовании химической
связи, а четвёртая с парой электронов
– нет. Углы между связямиN-Hне равны 90 о как в пирамиде, но и
не равны 109,5 о , соответствующие
тетраэдру.
sp3—
гибридизация в молекуле аммиака
При взаимодействии
аммиака с ионом водорода в результате
донорно-акцепторного взаимодействия
образуется ион аммония, конфигурация
которого представляет собой тетраэдр.
Пример
4.Объяснить с позиций метода МО
возможность существования молекулярного
иона Не2+
Решение:
В
молекулярном ионе Не2 + имеется три электрона.На связывающей
орбитали размещены два электрона,а на
разрыхляющей –один. Следовательно
кратность связи равна 0, и он должен быть
энергетически устойчивым.
Пример
5.Определите энергию связи
кислород-водород в молекуле Н2О
если энергия связи Н-Н и
О-О
соответственно равны -435,9 и -498,7 кДж/моль
а при сгорании 2 моль кислорода выделяется
483,68 кДж теплоты.
Решение:
Процесс
образования молекулы воды можно
представить следующим образом: рвутся
связи водород-водород и кислород-кислород
а образовавшиеся атомы соединяются в
молекулы Н2О каждая из которых
содержит две связи кислород-водород:
4Н(г) =
2Н2(г) – 435,9∙2
2О(г) =
О2(г) – 498,7
2Н2(г)
+ О2(г) = 2Н2О(г) — 483,68
—————————————————-
4Н(г) +
2О(г) = 2Н2О(г) — 1854,18 кДж
В двух
молекулах Н2О четыре связи
кислород-водород; средняя энергия связи
кислород – водород равна: -1854,18 / 4 = —
463,54 кДж/моль
ЗАДАЧИ
ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.Определите
тип гибридизации орбиталей центрального
атома в следующих молекулах и укажите
геометрическую форму этих молекул:
AlBr3,
BeF2,
CF4,
BBr3,
H2O,
SF6,
SiCl4,
NH3,
CH4,
AlCl3,
BCl3
Полярны
ли эти молекулы?
2.Определите
тип гибридизации орбиталей центрального
атома в следующих частицах и укажите
геометрическую форму этих частиц:
NH4+,
GaCl4—,
H3O+,BF4—,
SiF62-,
AlF63-,
SO42-,
PO43-.
3.Составьте
энергетическую диаграмму МО для следующих
частиц и определите порядок связи в
них:
H2,H2+,H2—,He2,
HeH, He2+,
Li2,
Be2,
B2,
N2,
N2+,
O2,
O2—,
O2+,
CO, CO+,
NO, NO+,
NO—.
4.
Пользуясь
таблицей относительных электроотрицательностей,
определите,какая
из связей является наиболее полярной:Са-Н,
I-C1.C-S.
5.
В
каком из приведенных соединений:LiF,
BeF
,BF
,CF
связь
Э-F будет
больше всего
приближаться
к ковалентной?
6.
Как
изменяется прочность связи в
ряду:НF-НСl-НВг-Н1?
7.
При
переходе от NaF
к Nal
температура плавления кристаллов
уменьшается. Объясните наблюдаемый ход
изменения температур плавления.
8.
BaCl2
в водных растворах -сильный электролит,a
HgCl2-слабый
электролит. Объясните это различие в
свойствах солей.
9.
Сероводород при обычной температуре
—
газ, а вода- жидкость. Чем можно объяснить
это различие в свойствах?
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
12.02.20151.51 Mб20POSOBIE_DLQ_PODGOTOVKI_K_EKZAMENU.rtf
- #
12.02.20153.69 Mб1918Posobie_dlya_10kl_gl_var.doc
- #
- #
- #
- #
- #
- #
- #
Чтобы рассчитать энергию связи в химической реакции, вы проверяете уравнение реакции и складываете энергии в связях молекул как для продуктов, так и для реагентов. Расчет показывает, является ли реакция экзотермической (выделяет тепло) или эндотермической (поглощает тепло).
TL; DR (слишком долго; не читал)
Чтобы рассчитать энергию связи в химической реакции, изучите уравнение реакции и сложите энергии в связях молекул как для продуктов, так и для реагентов.
Создание и разрыв облигаций
Атомы более стабильны и занимают более низкие энергетические состояния, когда связаны друг с другом. Когда вы вычисляете энергии связи, помните, что энергия в левой части уравнения переходит в разрыв связей молекул реагента, а энергия в правой части исходит от энергии, выделяемой путем образования связей в молекулах продукта.
Найти энергию связи
Чтобы рассчитать энергию связи, изучите уравнение для интересующей вас химической реакции. Обратите внимание на элементы, участвующие в реакции, и связи, которые удерживают их вместе. Найдите связи в таблице энергий связей и запишите каждую из них с обеих сторон уравнения. Также отметьте, если связь одинарная, двойная или тройная. Например, это уравнение для сжигания метана:
CH4 + 2O2 → 2H2O + CO2
В левой части уравнения у вас есть 4 водород-углеродные (одинарные) связи и 2 кислород-кислородные (двойные) связи. Правая сторона имеет 4 кислород-водородные (одинарные) связи и 2 углерод-кислородные (двойные) связи. Из таблицы видно, что каждая водород-углеродная связь составляет 413 кДж / моль, кислород-кислород — 495 кДж / моль, кислород-водород — 467 кДж / моль и углерод-кислород — 358 кДж / моль.
Рассчитать энергию связи
Для уравнения реакции умножьте количество связей на энергии связей:
(4) Углерод-водородные связи при 413 кДж / моль = 1652 кДж / моль.
(2) Кислород-кислородные связи (двойные связи) при 495 кДж / моль = 990 кДж / моль.
(4) Кислородно-водородные связи при 467 кДж / моль = 1868 кДж / моль.
(2) Углерод-кислородные связи (двойные связи) при 799 кДж / моль = 1598 кДж / моль.
Эндотермический или экзотермический?
Чтобы увидеть, является ли реакция эндотермической или экзотермической, сложите энергии для обеих сторон и сравните их. Левая сторона имеет 1652 кДж / моль + 990 кДж / моль = 2642 кДж / моль. Правая сторона имеет 1868 кДж / моль + 1598 кДж / моль = 3466 кДж / моль. Энергия, необходимая для разрыва связей в левой части уравнения, меньше энергии, выделяемой при создании связей в правой части. По соглашению, 2642 кДж / моль — 3466 кДж / моль = -824 кДж / моль. Отрицательное число означает, что энергия покидает реакцию в виде тепла. Поскольку общее число является отрицательным числом, реакция является экзотермической. Если бы число было положительным, реакция была бы эндотермической.