Проявляется
у элементов, имеющих сходные электронные
формулы. Элементы, входящие в подгруппу
электронных аналогов, аналогичны по
конфигурации внешнего электронного
слоя и достраивающихся внутренних
подуровней. Отнесению к электронным
аналогам не препятствуют отличия в
конфигурации благородного газа,
включенного в электронную формулу
([He]2,
[Ne]10
и т.д.); при этом конфигурация [Xe]544f14
считается эквивалентной конфигурации
благородного газа. Провал электрона
также не нарушает электронную аналогию.
Так, например, молибден ([Kr]364d54s1
и вольфрам [Xe]544f145d46s2)
являются электронными аналогами, хотя
их электронные формулы отличаются по
структуре как внешнего, так и внутренних
электронных слоев.
Различают
полные и неполные электронные аналоги.
Полные аналоги имеют аналогичные
электронные конфигурации в любых
степенях окисления. Неполные электронные
аналоги характеризуются сходными
электронными конфигурациями лишь в
некоторых степенях окисления.
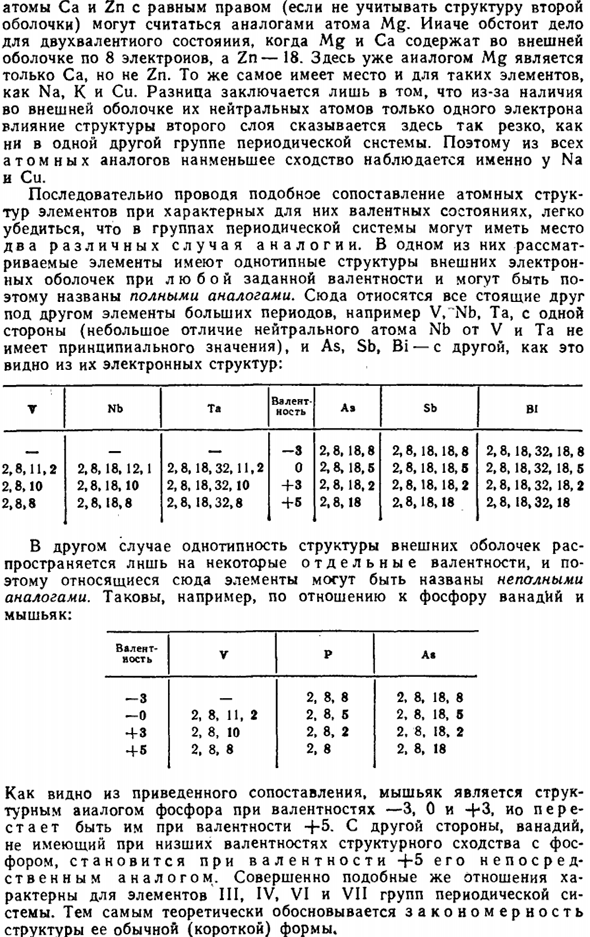
Рассмотрим
деление группы на подгруппы электронных
аналогов на примере VI
группы. Как следует из рис. 4., в группе
VI
можно выделить три подгруппы полных
электронных аналогов, соединенных
сплошными линиями. Первая из них включает
кислород и серу, вторая — селен, теллур
и полоний, третья — хром, молибден и
вольфрам; электронные конфигурации
атомов в любой из этих подгрупп аналогичны,
независимо от степени окисления. Так,
все элементы подгруппы селена в степени
окисления -2 имеют конфигурацию ns2np6,
в степени окисления +4 — ns2np2,
в степени окисления +6 — (n-1)d10.
В то же время элементы VI
группы образуют две подгруппы неполных
аналогов. В одну из них входят кислород,
сера, селен, теллур и полоний, соединенные
на рис. 4 прерывистой линией. Эти элементы
имеют аналогичные электронные конфигурации
во всех степенях окисления, кроме высшей.
Действительно, в степени окисления +6
сере отвечает электронная формула
[Ne]10,
а селену — [Ar]183d10,
хотя во всех остальных степенях окисления
(-2, +4) электронные конфигурации сравниваемых
элементов позволяют считать их аналогами.
Вторую подгруппу неполных электронных
аналогов образуют кислород, сера, хром,
молибден и вольфрам (пунктирная линия
на рис. 4). Для этой подгруппы аналогичные
электронные конфигурации отвечают лишь
высшей степени окисления элемента: как
видно на рис. 4 в степени окисления +6 все
они имеют конфигурацию благородного
газа.
На
такие же подгруппы электронных аналогов
подразделяются также III-V
и VII
группы периодической системы, т.е. все
группы, состоящие из p-
и d-элементов.
Группы, включающие s-
и d-элементы,
имеют несколько иную структуру. В этом
случае все элементы А-подгруппы являются
полными электронными аналогами, в
результате чего в группе могут быть
выделены две подгруппы полных электронных
аналогов и одна подгруппа неполных
аналогов, объединяющая первые два
элемента А-подгруппы и все элементы
В-подгруппы: эти элементы имеют аналогичные
конфигурации только в нулевой степени
окисления. На рис. 4 показана структура
I
группы периодической системы; в этой
группе подгруппы полных электронных
аналогов образуют элементы литий,
натрий, калий, рубидий, цезий и медь,
серебро, золото, а подгруппа неполных
аналогов (волнистая линия на рис. 4.)
объединяет литий, натрий, медь, серебро
и золото — элементы, имеющие в нулевой
степени окисления электронную конфигурацию
ns1.
VIII
группа, включающая элементы с разным
числом валентных электронов, естественно,
имеет иную структуру. Она состоит из
пяти подгрупп полных электронных
аналогов (неон, аргон; криптон, ксенон,
радон; железо, рутений, осмий; кобальт,
родий, иридий; никель, палладий, платина)
и одной подгруппы неполных электронных
аналогов (неон, аргон, железо, рутений,
осмий) с конфигурацией благородного
газа в степени окисления +8.
Электронная
аналогия представляет собой еще более
узкий тип аналогии, нежели типовая.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Электронные аналоги в химии
- Электронные аналоги. Необходимой предпосылкой для возможности рационального рассмотрения фактического материала обобщения на основе периодических законов является правильный подбор сходных элементов. Это разделение, руководствуясь простой близостью определенных признаков, сделать нельзя, так как не только формальное сходство между ними, но и регулярные различия, отражающие развитие атомной структуры рассматриваемого ряда, служат признаком сходства рассматриваемого ряда. elements.
- It именно эти структуры как детерминанты всего химического поведения элемента лежат в основе правильного подбора аналогов. Если нейтральные и элементарные ионы (ионизированные атомы) представляют собой неструктурированные шары, то их свойства определяются только величиной заряда и радиусом. Как правило, на внешней оболочке играет решающую роль в определении наиболее важных химических свойств.
Но на самом деле, структура электронной оболочки-это очень важно.
Людмила Фирмаль
Зависимость свойств атомов и ионов от внешнего 2-го слоя уже менее выражена(влияние их структуры не столь выражено, электронов во внешнем слое больше, а электронов во 2-м рассматриваемом слое меньше).Значение структуры, даже более глубокой, чем лежащий электронный слой (за исключением атомов лантаноидов и актинидов), сводится почти к нулю. Таким образом, при разделении аналогов, в первом приближении, можно рассматривать только внешнюю оболочку, учитывая только особенности (в основном в атомах переходного металла) и 2-й элемент, если это необходимо.
Принимая это во внимание, рассмотрим такие элементы, как Mg, Ca и Zn. Если валентность равна нулю(то есть форма нейтрального атома), то все они имеют по 2 электрона во внешнем shell. So … Атомы Ca и Zn с равными правами(если не принимать во внимание структуру 2-й оболочки) можно считать аналогами атома Mg. Иначе обстоит дело, когда Mg и Ca содержат по 8 электронов во внешней оболочке, причем в 2-валентном состоянии, которым является Zn-18.Вот, только, не зн, это аналог мг.
То же самое относится и к таким элементам, как Na, K и Cu. Единственное отличие состоит в том, что во внешней оболочке нейтрального атома имеется только 1 электрон, поэтому здесь влияние структуры 2-го слоя проявляется не так резко в других группах периодической системы. Таким образом, среди всех атомных аналогов наименьшее сходство наблюдается именно в Na и Cu.
Последовательно проводя такое сравнение атомной структуры элемента в характерном валентном состоянии. In 1 из них рассматриваемый элемент имеет тот же тип строения, что и внешняя электронная оболочка для любой валентности, поэтому его можно назвать полным аналогом. Сюда относятся, например, V, 1Mb.
Легко увидеть, что в группе периодических элементов могут возникать 2 различные аналогии systems.
Людмила Фирмаль
Ta (небольшая разница между нейтральными атомами Nb и V и Ta в основном незначительна), а также все элементы большого периода друг под другом, такие как As, Sb, Bi и т. д.: Т НБ Т «валентность Ле-СБ Би _ −3 2.8、18.8 2.8、18.18.8 2.8、18.32、18.8 2,8,11,2 2,8,18,12,1 2,8、18、32,11,2 0 2,8,18,5 2,8,18。 18.5 2.8. 18.32, 18.5 2.8.10 2.8.18.10 2.8、18.32.10 +3 2、8、18.2 2,8,18,18,2 2,8,18,32、18,2 2.8.8 2.8.18.8 2.8、18.32.8 +5 2.8.18 2.8.18.18 2.8、18.32.18
В другом случае однородность структуры внешней оболочки распространяется на индивидуальную валентность, поэтому элементы, связанные здесь, можно назвать несовершенными аналогами. Например, фосфор, ванадий и мышьяк: V P A растяжение позвоночника » −3 _ 2、8、8 2.8、18. Восемь −0 2, 8. 11, 2 и 2. 8. 5-2. 8. 18. Б 43, 2, 8. 10 2, 8, 2, 2. 8. 18, 2 часа дня. Черное и белое 2、8、8 2、8 2、8、18 Как видно из приведенного выше сравнения, мышьяк является структурным аналогом фосфора с валентностью-3, 0, а с валентностью-f-5 фосфор элиминируется.
Ванадий, с другой стороны, имеет низкую валентность и не имеет структурного сходства с фосфором, а с валентностью-f-5 он становится его прямым аналогом. Довольно схожие соотношения характерны для элементов III, IV, VI и VII группы периодической system. So, теоретически, мы продемонстрируем закономерность структуры обычной (короткой) формы. Из вышеизложенного следует, что для всех валентностей, за исключением положительной группы, соответствующей числу (которое можно назвать характеристическим, как правило, максимумом), задан один и тот же ряд сходных элементов (а), а значение характеристики-множество (Б) существенно отличается:
Группа I G1 III IV V VI VI VII Есть ли на Кей Си быть мг Са ЗН Б Ал Ка га с-Си-Ти ГК Н П в Асос СГ ГП ф ки млн Бр B Li Na K Si Be Mg Ca Zn B Al Sc Ga C Si Ti Ge N P V As (0) s Cr Se (F) CI Mn Br Распределение обоих аналогов четко показано следующими изменениями в периодической системе (стр. 2. 36).Сплошная линия на нем соединена с полным аналогом. Большая пунктирная линия-это элемент, который подобен всем валентностям, кроме характеристики, а маленькая пунктирная линия-это элемент, который подобен присутствию (и только если есть) характеристической валентности.
Значок|а| актинидов с анемонами | актинидов с фонарем / значок / актинидов с фонарем. Как удобно пользоваться системой, обратите внимание на номер каждой строки аналога (кроме 8, 9 и 10).Прямой или минус 10 соответствует номеру труппы. Например, в 3-й группе левая подгруппа (включая элемент начала периода) и правая подгруппа (включая элемент конца периода) образованы строками 4 и 4, строками 14, строками 3 и 13 соответственно.
Для всех валентных состояний, характерных для них, а также для формы нейтральных атомов, она является оптимальной для классификации химических веществ на ее основе. Добавь 1) определение положения водорода в системе требует дополнительного discussion. In при формальном подходе к строению своих атомов водород становится аналогом лития.
Однако природа внешней электронной оболочки определяет аналогии элементов не сами по себе, а лишь в свете общих закономерностей развития структуры. По последним миграциям периода 2!С подобным элементом положительный заряд ядра и количество внешних электронов уменьшаются на 8 единиц (Ne — » — He). так, по сути, нейтральный атом водорода является аналогом атома фтора.
С отрицательной валентностью водород также относится к фтору, как гелий к неону. От Li до Na и так далее. Кроме того, если он положительный(если это голый Протон), он не имеет аналогов с другими элементами、 Стоя полностью away. So, водород является несовершенным аналогом фтора. Близость к семейству галонов совпадает со всей совокупностью физических свойств водорода. 2) рассмотренная выше структура внешней электронной оболочки помимо формального сходства щелочных металлов и водорода, ее размещение в первой группе часто мотивируется it.
In химические взаимодействия, водород обычно ведет себя как металл. Однако в большинстве случаев поведение такого водорода упускается из виду, что характерно только для реакций, протекающих в водной среде solutions. In дело в том, что наиболее частой встречей является реакция такого водорода, но если характеризовать его как элемент, то нельзя отводить ему решающую роль, так как химическая функция атома сильно искажается здесь особыми свойствами положительных не (голых протонов).
Степень металличности элемента оценивается по легкости расщепления электронов его атомов. С этой точки зрения сравните натрий, водород и хлор. На + 118 ккал на * + е сі + 300 ккал СГ + е H + 315 ккал H * + e Как показывают эти данные, энергия ионизации водорода не только резко превышает энергию ионизации удара, но и несколько превышает энергию ионизации хлора. Поэтому нет вопроса о том, какова специфика функций металла для свободных атомов водорода.
В присутствии воды появляется дополнительный эффект-гидратация как о, так и О, где среди интересующих количеств не-С1 * энергия гидратации неизвестна, но в этом приближенном расчете она может быть равна энергии гидратации Ионов Na4.Тогда у нас есть: На * + р-р = » = * НВ-101 ккал Ф СГ + СГ с AQ + 101 ккал H * + aq H * + 265 ккал Суммируя все уравнения трн для каждого из предыдущих уравнений и членов, мы получаем сводку поведения атомов в водной среде.
Na + aq-f 17 ккал Na * + e CI + aq + 199 ккал CV + e Н-ф р-р + 50 ккал ч ’+ е Как видно из этих результатов, водород во входной среде очень близок к Na. Чем C1, то есть в этих условиях он действительно напоминает металл. Однако это сходство не присуще самому атому, и поэтому оно не может служить основанием для определения местоположения водорода в периодической системе. Структурная однородность атома и атомов элементов 1-й группы имеет те же формальные свойства, что и однородность атома гелия и атомов элементов 2-й группы.
Смотрите также:
Предмет химия
Доброго дня химики!
Немогу разобраться с тем, что такое электронные-аналоги( В инете нашел, что элементы имеющие одинаковое электронное строение, но ведь такого не бывает.
Есть 7 элементов : Иттрий , Цирконий , Ниобий , Молибден, Технеций , Рутений, Родий
Как определить какие из них явдляются электронными аналогами?
зы: электронно-графические формулы прилагаются
Зарание благодарю!
Изменено 19 Февраля, 2012 в 12:04 пользователем pimi
Электронный аналог
Cтраница 1
Электронные аналоги являются химическими аналогами.
[1]
Электронные аналоги ( атомы или ионы) характеризуются близкими химическими свойствами.
[2]
Электронные аналоги Мп-Тс, Re, находящиеся в 5 и 6 периодах, обладают более явными металлическими свойствами и такого резкого падения температуры плавления у них нет.
[4]
Электронные аналоги электрохимических ячеек могут оказаться весьма полезными при применении разностного способа измерения — для формирования опорных ( компенсирующих) электрических сигналов, воспроизводящих фарадеевский ток, соответствующий определяемому компоненту с заданной концентрацией, или ток помехи, обусловленный зарядом емкости двойного слоя и электрохимической реакцией посторонних веществ. Такое применение эквивалента ячейки целесообразно при выполнении массовых однотипных анализов.
[5]
Электронными аналогами называются элементы, у которых валентные электроны расположены на ор-биталях, описываемых общей для всех элементов формулой. В периодической системе элементов электронные аналоги входят в состав одной подгруппы.
[6]
Электронными аналогами называются элементы, у которых валентные электроны расположены на орби-талях, описываемых общей для всех элементов формулой.
[7]
Электронными аналогами называются элементы, у которых валентные электроны расположены на ор-биталях, описываемых общей для всех элементов формулой. В периодической системе элементов электронные аналоги входят в состав одной подгруппы.
[8]
Ближайшими электронными аналогами наиболее исследованных бинарных полупроводников типа А3В5 являются тройные соединения типа А2В4С52, которые и были объектом настоящего исследования. Следует отметить, что между соединениями А3В5 и А2В4СГ 2 имеется и определенное различие, заключающееся в том, что тройные соединения кристаллизуются, в основном, в тетрагональной решетке типа халькопирита, тогда как бинарные — обладают кубической решеткой типа сфалерита. Другим обстоятельством, отличающим тройные соединения от бинарных, является усложнение состава, но можно предположить, что это обстоятельство играет менее существенную роль, как следует из сопоставления свойств элементарных ( А4) и бинарных тетраэдрическнх кристаллов.
[9]
Это полные электронные аналоги, последние из d — элементов, у которых завершен d — подуровень. В этом отношении цинк и его аналоги отличаются от остальных d — элементов.
[10]
Блок-схема электронного аналога системы дифференциальных уравнений (6.20) показана на рис. 6.9. С помощью АВМ можно получить амплитудно-частотную характеристику [ и исследовать зависимость резонансных амплитуд от различных параметров.
[11]
Сера — электронный аналог кислорода, типичный элемент VI группы периодической системы. На ее внешнем электронном слое 6 электронов, а поэтому она довольно легко присоединяет два электрона, проявляя окислительные свойства. Кроме того, сера проявляет восстановительные свойства. Свободная сера может существовать в виде нескольких аллотропных форм: ромбической, моноклинической, пластической.
[12]
В подгруппах электронных аналогов радиусы атомов сверху вниз увеличиваются вместе с увеличением числа электронных уровней.
[13]
У его электронных аналогов, находящихся в разных периодах, возможно возникновение других форм связи за счет наличия другого числа свободных ор -, биталей.
[15]
Страницы:
1
2
3
4
Какие электронные аналоги называют полными и какие — неполными [c.296]
К побочной подгруппе седьмой группы относятся -элементы марганец Мп, технеций Тс и рений Ке — полные электронные аналоги. Валентными у них являются (п—1)й /15 -электроны [c.387]
Марганец Мп, технеций Тс и рений Ке — полные электронные аналоги с конфигурацией валентных электронов п— )д. п . Они объединяются в подгруппу марганца. Некоторые сведения об этих элементах приведены ниже [c.568]
Марганец Мп, технеций Тс и рений Re — полные электронные аналоги с конфигурацией валентных электронов п—l)d ns [c.324]
На чем основывается деление элементов со сходной электронной структурой внешних слоев атомов на полные и неполные аналоги Выделить полные аналоги среди s-элементов I и II групп среди р-элементов V и VI групп Периодической системы. [c.15]
Б. В. Некрасов (1935), чтобы отразить влияние структуры внешних электронных оболочек атомов на свойства элементов во всех степенях окисления, рассматривает два различных случая анало гни. В одном из них элементы имеют одинаковые структуры при любой заданной степени окисления и называются полными аналогами. В другом случае одинаковость структур внешних оболочек распространяется лишь на некоторые отдельные степени окисления. Относящиеся сюда элементы называются неполными аналогами. В его варианте системы (с. 87) сплошными линиями соединены полные аналоги, крупным пунктиром — элементы, аналогичные при всех валентностях, кроме характеристической (равной номеру группы), мелким пунктиром — элементы, являющиеся аналогами только при характеристической валентности. [c.85]
Если объект представляет собой монолит, то проводят его локальный или послойный анализ без предварительного разрушения. Наиболее детальный анализ поверхности можно провести с помощью ионного зонда. С помощью специальных технических приемов можно получить на телевизионном экране или фотопленке увеличенное изображение поверхности объекта, образованное ионами выбранного элемента. Повернув ручку настройки масс-анализатора, получают изображение того же участка поверхности, образованное ионами другого элемента. Набор таких фотоснимков представляет собой полную топографию интересующих элементов в выбранной области поверхности образца. Прибор, работающий по- такому принципу, называется ионным микрозондом и является аналогом электронного микрозонда, или электронно-зондового рентгеновского микроанализатора (см. гл. 5). Его преимуществами являются более высокая чувствительность, особенно к легким элементам, а также возможность изучать не только элементный, но и изотопный состав образца. [c.216]
Элементы IV группы — титан Ti, цирконий Zr, гафний Hf и курчатовий Ки — полные электронные аналоги, образуют подгруппу титана. [c.528]
Германий Ое, олово 8п и свинец РЬ — полные электронные аналоги. Как и у типических элементов группы, валентными у них являются 5-р -электроны. [c.481]
Мышьяк As, сурьма Sb и висмут Bi — полные электронные аналоги с конфигурацией По мере увеличения размеров атомов в ряду As — Sb — Bi значения устойчивых координационных чисел возрастают. Степени окисления мышьяка, сурьмы и висмута равны —3, 4-3 и +5. Вследствие особой устойчивости конфигурации 6s для висмута наиболее характерна степень окисления +3. [c.379]
Мышьяк Аз, сурьма 5Ь и висмут — полные электронные аналоги с конфигурацией [c.423]
Бром Вг, иод I и астат At — полные электронные аналоги (стр. 28). Некоторые их константы, а также константы типических элементов УЦ группы приведены ниже [c.313]
Цинк Zn, кадмий d и ртуть Hg — полные электронные аналоги каждый в своем периоде является последним элементом d-семейства. Следовательно, у них завершена -электронная конфигурация. В этом отношении цинк и его аналоги отличаются от остальных d-элементов и, наоборот, проявляют сходство с / -элементами боль- [c.630]
Наиболее близки по свойствам селен и теллур, являющиеся полными электронными аналогами и несколько отличается от них сера — их неполный электронный аналог [c.184]
В подгруппу кальция входят з-элементы кальций Са, стронций Зг, барий Ва и радий Ка, являющиеся полными электронными аналогами. [c.573]
Никель N1, палладий Рс1 и платина — полные электронные аналоги — характеризуются следующими константами [c.644]
При моделировании технологического процесса мы добиваемся возможно полной адекватности электронной модели и процесса. При этом в равной степени можно утверждать, что электрические процессы, протекающие в аналоговой вычислительной машине, отражают химико-технологический процесс или, что химико-техно-логический процесс отражает электрические процессы, протекающие в данной схеме аналоговой вычислительной машины. Следовательно, можно проектировать процессы таким образом, чтобы часть (или все) функции САУ могли быть возложены на сам процесс или на процесс, организованный параллельно основному и осуществляющий, помимо получения желаемого продукта, управление основным технологическим процессом. Параллельно работающий химико-техноло-логически процесс в данном случае является технологическим, аналогом электронного (или пневматического) регулятора. [c.488]
Почему при наличии двух электронов во внешнем слое у атомов кальция и цинка они не являются полными химическими аналогами [c.22]
Эго утверждение, строго говоря, неверно. Согласно законам кванто-чой механики, даже система, полная энергия которой меньше потенциальной энергии на вершине барьера, имеет некоторую вероятность перейти в конечное состояние. Такой переход системы в конечное состояние, минуя вершину барьера, получил название туннельного эффекта. Туннельный эффект — явление чисто квантовомеханическое, не имеющее аналогии в классической физике. Вероятность туннельного эффекта тем больше, чем ниже и чем тоньше барьер, а также чем меньше масса частицы. Поэтому можно ожидать, что туннельный барьер играет известную роль в процессах, связанных с переходом электрона, т.е, в окислительно-восстановительных реакциях. Однако вопрос о роли туннельного эффекта даже в этих реакциях является дискуссионным. При дальнейшем изложении возможность туннельного эффекта не будет приниматься во внимание. [c.63]
Следует иметь в виду, что для характеристики свойств элементов одной подгруппы важное значение имеет сходство или различие электронной конфигурации их в различных степенях окисления. Б. В. Некрасовым в связи с этим были введены представления о полных и неполных электронных аналогах. Полные электронные аналоги имеют одинаковую электронную конфигурацию при всех степенях окисления, неполные электронные аналоги — только при определенных значениях. На основе различий электронных конфигураций атомов в высших степенях окисления были объяснены особенности свойств элементов малых периодов по сравнению со сходными элементами больших периодов. [c.67]
Цинк 2п, кадмий С(1 и ртуть Н — полные электронные аналоги каждый в своем периоде является последним элементом -семейства. Следовательно, у них завершена «-электронная конфигурация. В этом отношении цинк и его аналоги отличаются от остальных -элементов и, наоборот, проявляют сходство с р-элементами больших периодов. Приведем некоторые сведения об элементах подгруппы цинка [c.579]
Криптон Кг, ксенон Хе и радон Rn, являясь полными электронными аналогами, объединяются в подгруппу криптона. Некоторые данные о криптоне и его аналогах, а также о типических элементах VHI группы приведены ниже [c.612]
Кобальт Со, родий КЬ и иридий 1г — полные электронные аналоги. [c.632]
Можно говорить о двух типах аналогии по вертикальным и горизонтальным столбцам периодической системы. Как уже отмечалось, в первом случае это будут электронные аналоги двух типов полные и неполные (речь идет о короткой форме системы). Тогда полными электронными аналогами выступают атомы одной подгруппы , а неполными — главной и побочной подгрупп. Примером вертикальной аналогии могут служить представители всех четырех типов свободных атомов [c.47]
Процесс мысленного построения атомов для элементов третьего периода периодической системы осуществляется в полной аналогии с построением атомов элементов, находящихся во втором периоде. Каждый новый электрон оказывается связанным более прочно из-за увеличивающегося заряда ядра. Некоторые отклонения от этой простой зависимости наблюдаются только у алюминия,, Л1, и серы, 5 эти аномалии объясняются заполнением Зх-орбиталей у предыдущего атома магния, М , и образованием полузаполненной оболочки Зр у предыдущего атома фосфора, Р [c.396]
Мышьяк, сурьма н висмут являются полными электронными аналогами. Второй снаружи электронный слой атомов этих элементов в отличие от азота и фосфора содержит 18 электронов. Степени окисления Аз, 5Ь и В1 равны —3, +3 и +5. [c.304]
Калпй К, рубидий НЬ, цезий С8 и франций Рг — полные электронные аналоги. Хотя у атомов щелочных металлов число валентных электронов одинаково, свойства элементов подгруппы калия отличаются от свойств натрия и, особенно, лития. Это обусловлено заметным различием величин радиусов их атомов и ионов. Кроме того, у лития в предвнешнем квантовом слое 2 электрона, а у элементов подгруппы калия 8. Ниже приведены некоторые сведения о литии, натрии и об элементах подгруппы калия [c.592]
Это полные электронные аналоги, последние из d-элементов, у которых завершен -подуровень. В этом отношении цинк и его аналоги отличаются от остальных d-элементов. [c.420]
Частицы, обладающие магнитным моментом, не равным нулю, называют парамагнитными. В отсутствие внешнего магнитного поля они ориентированы хаотично и вещество в целом магнитных свойств не проявляет. Однако в магнитном поле они частично разворачиваются по направлению поля, и в веществе возникает наведенный магнитный момент. Отнесенный к единице объема этот суммарный магнитный момент называется намагниченностью вещества Р — Основной вклад в намагниченность вносят частицы, обладающие парамагнетизмом электронного происхождения. Вклад парамагнитных ядер в намагниченность ничтожен в силу малой величины магнитных моментов ядер. Описанная намагниченность по физическому смыслу является полным аналогом ориентационной поляризованности вещества в электрическом поле, описанной в предыдущем параграфе. В частности ее величина связана с магнитным моментом частиц рт соотношением, аналогичным (5.3) [c.90]
Сравнивая число непарных электронов (а именно они могут участвовать в образовании химических связей) у элементов одной группы, казалось бы, наблюдаем полную аналогию. Однако при химическом взаимодействии атомы элементов третьего периода проявляют, а второго не проявляют валентность, равную номеру группы (степень окисления азота, правда, может достигать -4-4 и +5. но тому есть свое объяснение). [c.39]
Этилнитрат [299—301]. Спектр поглощения показан на рис. 5-17 при 2537—2654 А важен процесс (1) при 3130 А ф1>0,24, фг<0,09, Фз<0,14 при облучении полным светом водородной лампы (через флюори-товое окно) наблюдается флуоресценция электронно-возбужденных этоксиль-ных радикалов, образующихся по реакции (1) (вероятно, аналог электронного состояния, наблюдаемого в полосе испускания ОН около 3064 А в этом переходе участвует пеподеленный электрон кислорода, промотируемый на разрыхляющую С — 0-орбиталь) [187]. [c.393]
Германий Ое, олово 5п и свинец РЬ — полные электронные аналоги. Как и у типических элементов группы, валентными у них являются 5 р -э.1ектроны. В ряду Ое — 5п — РЬ уменьшается роль внешней [c.421]
Атомы элементов главной подгруппы V группы периодической системы имеют во внешних электронных оболочках 5 электронов. В соответствии с этим для азота и его аналогов должны быть характерны отрицательная валентность —3 и высшая положительная валентность 4-5. Однако если предположение о высшей положительной валентности, равной +5, в полной мере обосновано для аналогов азотафосфора, мышьяка — сурьмы и висмута, то для самого азота оно может быть принято лишь условно. В самом деле, свою высшую положительную валентность элементы проявляют обычно в соедине- [c.77]
ЯВЛЯЮТСЯ ПОЛНЫМИ электронными анапогами, так как у атомов этих элементов электронные конфигурации внешней и предвнешней электронных оболочек совпадают (п — 1)в р п5. Отличие химических свойств этих элементов определяется, а основном, значением п. Аналогично выделяют частичньге и полные электронные аналоги в подгруппе ПА элементов табл. 14.1). Так, бериллий и кальций являются частичными электронными ангалогами, а кальций и барий [c.380]
Германий, олово и свинец являются полными электронными аналогами. В отличие от углерода и кремния предвнешний слой их атомов содержит 18 электронов. [c.284]
К побочной подгруппе четвертой группы относятся титан цирконий 2г. гафний НГ и курцятпний Кн Эти ( -элементы — полные электронные аналоги. Валентными являются п—1)й -Ъ5—элек-троны [c.364]
Наличие в нормальной конфигурации наряду с -электронами -электроноЕ делает аналогию между конфигурациями и между термами изоэлектронных атомов и ионов менее полной, чемвслу-чае элементов с заполняющимися р-оболочками. Вместе с тем обнаруживается сходство между нейтральным атомом и нонами данного элемента. Одинаковые совокупности термов получаются для конфигураций (п—l) гs и (п—1) нейтрального и дважды ионизированного атома. Сохраняется значительное сходство ней-грального и однократно ионизированного атомов ( 5 и 5,). [c.222]