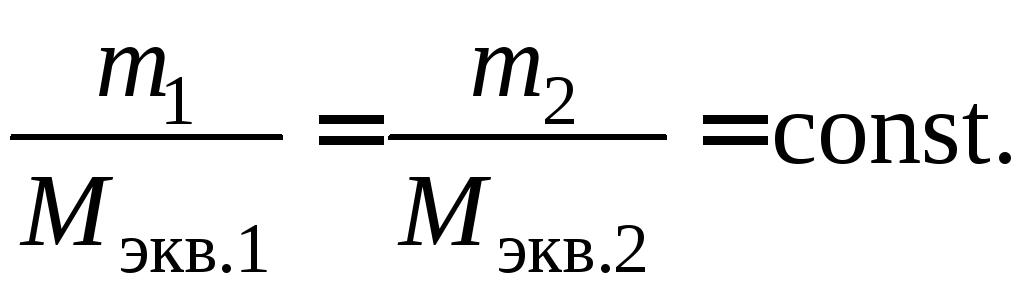Печатать книгу
| Сайт: | Профильное обучение |
| Курс: | Физика. 10 класс |
| Книга: | § 35. Электрический ток в электролитах |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 28 Май 2023, 06:10 |
Оглавление
- Природа электрического тока в электролитах
- Закон электролиза Фарадея
- Техническое применение электролиза
- Примеры решения задач
- Упражнение 25
При изучении предыдущего параграфа вы узнали, что в металлах перенос заряда не сопровождается переносом вещества, а носителями свободных зарядов являются электроны. Но существует класс проводников, прохождение электрического тока в которых всегда сопровождается химическими изменениями и переносом вещества. Какова природа электрического тока в таких проводниках?
Природа электрического тока в электролитах. Из опытов следует, что растворы многих солей, кислот и щелочей, а также расплавы солей и оксидов металлов проводят электрический ток, т. е. являются проводниками. Такие проводники назвали электролитами.
Электролиты — вещества, растворы или расплавы которых проводят электрический ток.
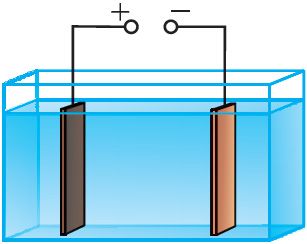
Проведём опыт. Соберём электрическую цепь, состоящую из источника тока, лампы накаливания и ванны с дистиллированной водой, в которой находятся два угольных электрода. При замыкании цепи лампа не светится, следовательно, дистиллированная вода не проводит электрический ток. Повторим опыт, добавив в дистиллированную воду сахар. Лампа не светится и в этом случае. Раствор сахара в воде также не является проводником. А теперь добавим в дистиллированную воду небольшое количество соли, например, хлорида меди(II) CuCl2. В цепи проходит электрический ток, о чём наглядно свидетельствует свечение лампы (рис. 200). Следовательно, раствор соли в воде является проводником электрического тока, т. е. при растворении хлорида меди(II) в дистиллированной воде появились свободные носители электрического заряда.
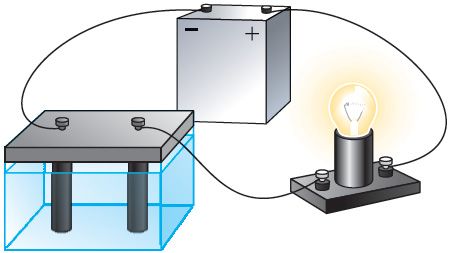
Изучая химию, вы узнали, что при растворении солей, кислот и щелочей в воде происходит электролитическая диссоциация, т. е. распад молекул электролита на ионы. В проведённом опыте хлорид меди(II) CuCl2 в водном растворе диссоциирует на положительно заряженные ионы меди Cu2+ и отрицательно заряженные ионы хлора Cl−.
Ионы Cu2+ и Cl− в растворе при отсутствии электрического поля движутся беспорядочно. Под действием внешнего электрического поля на беспорядочное движение ионов накладывается их направленное движение (рис. 201). При этом положительно заряженные ионы Cu2+ движутся к катоду (электроду, подключённому к отрицательному полюсу источника тока), отрицательно заряженные ионы Cl− — к аноду (электроду, подключённому к положительному полюсу источника тока). На аноде будет происходить процесс окисления ионов Cl− до атомов.
Нейтральные атомы образуют молекулы хлора, который выделяется на аноде:
На катоде будет происходить процесс восстановления ионов Cu2+ до нейтральных атомов и осаждение металлической меди:
Это явление называют электролизом.
Электролиз — процесс выделения на электроде вещества, связанный с окислительно-восстановительными реакциями, протекающими при прохождении электрического тока через растворы (расплавы) электролитов.
Таким образом, свободные носители электрического заряда в электролитах — положительно и отрицательно заряженные ионы, которые образуются в результате электролитической диссоциации, а проводимость электролитов является ионной. Электролиты относят к проводникам второго рода.
От теории к практике
Почему опасно прикасаться голыми руками к неизолированным металлическим проводам, по которым проходит электрический ток?
Закон электролиза Фарадея. Закон электролиза был экспериментально установлен Фарадеем в 1833 г.
Масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
В формуле (1) коэффициент пропорциональности k называют электрохимическим эквивалентом данного вещества. Он численно равен массе вещества, выделившегося на одном из электродов при прохождении через электролит единичного электрического заряда. В СИ электрохимический эквивалент измеряют в килограммах на кулон . Значения электрохимических эквивалентов некоторых веществ приведены в таблице.
| Вещество | k, 10-8 |
Вещество | k, 10-8 |
| Алюминий | 9,32 | Никель (двухвалентный) | 30,4 |
| Водород | 1,04 | Никель (трёхвалентный) | 20,3 |
| Кислород | 8,29 | Хлор | 36,7 |
| Медь (одновалентная) | 65,9 | Хлом | 18,0 |
| Медь (двухвалентная) | 32,9 | Цинк | 33,9 |
Поскольку q = It, где I — сила тока, t — промежуток времени прохождения тока через электролит, то
m = kIt.
От теории к практике
Никелирование изделия двухвалентным никелем осуществлялось в течение промежутка времени t = 20 мин при силе тока I = 15 А. Определите массу слоя никеля, осаждённого на изделии.
Массу m вещества, выделившегося на электроде при прохождении через электролит электрического заряда q, можно определить, зная массу m0 одного иона и число N осевших на этом электроде ионов:
,
,
где M — молярная масса выделившегося вещества, NА — постоянная Авогадро.
Тогда число ионов: .
С другой стороны, число ионов, нейтрализовавшихся на электроде:
где q0 — заряд одного иона. Так как заряд иона q0 кратен элементарному заряду e, то q0 = en, где n — валентность иона.
Значит, и
(2)
Сравнивая формулы (2) и (1), получим
(3)
Так как NА и е – универсальные постоянные, то физическую величину в честь М. Фарадея назвали постоянной Фарадея.
С учётом этого формулу (3) для определения электрохимического эквивалента вещества можно записать в виде:
Используя закон электролиза, можно определить значение заряда электрона в школьной лаборатории. Допустим, что I — сила тока, который проходил через электролит в течение промежутка времени t (можно измерить амперметром). При этом на электроде выделилось вещество, масса которого m (можно измерить, взвесив электрод до и после прохождения тока через электролит). Тогда модуль заряда электрона определяют по формуле.
Техническое применение электролиза. Электролиз нашёл различные применения в промышленности. Рассмотрим некоторые из них.
1. Нанесение защитных и декоративных покрытий на металлические изделия (гальваностегия).
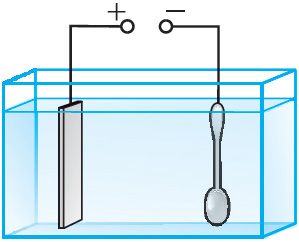
Для предохранения металлов от окисления, а также для придания изделиям прочности и улучшения внешнего вида их покрывают тонким слоем благородных металлов (золотом, серебром) или малоокисляющимися металлами (хромом, никелем). Предмет, подлежащий гальваническому покрытию, например, ложку (рис. 202), погружают в качестве катода в электролитическую ванну. Электролитом является раствор соли металла, которым осуществляется покрытие. Анодом служит пластина из такого же металла. Пропуская через электролитическую ванну в течение определённого промежутка времени электрический ток, ложку покрывают слоем металла нужной толщины. Для наиболее равномерного покрытия ложки её необходимо поместить между двумя или более анодными пластинами. После покрытия ложку вынимают из ванны, сушат и полируют.
2. Производство металлических копий с рельефных моделей (гальванопластика).
Для получения копий предметов (монет, медалей, барельефов и т. п.) делают слепки из какого-нибудь пластичного материала (например, воска). Для придания слепку электропроводности его покрывают графитовой пылью, погружают в электролитическую ванну в качестве катода и получают на нём слой металла нужной толщины. Затем, нагревая, удаляют воск.
Процесс гальванопластики был разработан в 1836 г. русским академиком Б. С. Якоби (1801–1874).
3. Получение металлов из расплавленных руд и их очистка, электрохимическая обработка металлов.
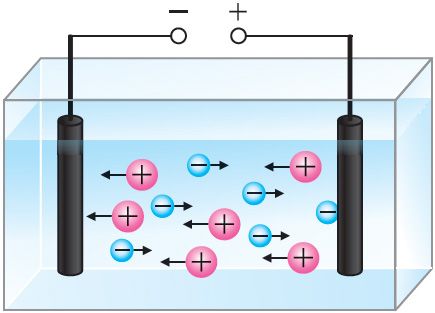
Процесс очистки металлов происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластина из чистого металла, а электролитом — раствор соли данного металла. Например, пластину из неочищенной меди помещают в качестве анода в ванну с раствором медного купороса, где катодом служит лист чистой меди (рис. 203). В загрязнённых металлах могут содержаться ценные примеси. Так, в меди часто содержатся никель и серебро. При пропускании через ванну электрического тока медь с анода переходит в раствор, из раствора на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
1. Что называют электролитом?
2. Какова природа электрического тока в электролитах?
3. Какой процесс называют электролизом?
4. Приведите примеры использования электролиза.
5. Сформулируйте закон электролиза. Каков физический смысл электрохимического эквивалента?
6. Через электролитическую ванну, наполненную раствором сульфата меди(II) CuSO4, пропускают электрический ток. Изменится ли масса меди, выделяющейся на катоде за одинаковые промежутки времени, если увеличить напряжение между электродами? увеличить температуру раствора электролита? увеличить концентрацию раствора электролита? Почему?
Примеры решения задач
Пример 1. Через электролитическую ванну, содержащую раствор серной кислоты, в течение промежутка времени t = 60,0 мин проходил ток. Выделившийся на катоде газообразный водород собран в сосуде вместимостью V = 350 см3. Определите температуру водорода, если его давление p = 150 кПа, а сила тока, проходившего через электролитическую ванну, I = 1,20 А.
Дано:
t = 60,0 мин = 3,60 · 103 с
I = 1,20 А
V = 350 см3 = 3,50 · 10–4 м3
p = 150 кПа = 1,50 · 105 Па
T — ?
Решение: Для нахождения температуры водорода воспользуемся уравнением Клапейрона‒Менделеева:
где М = 2,02 · 10-3 — молярная масса водорода, R = 8,31
— универсальная газовая постоянная. Следовательно,
. Массу водорода, выделившегося на катоде, определим, воспользовавшись законом электролиза: m = kIt, где k — электрохимический эквивалент водорода (k = 1,04 · 10–8
). С учётом этого температуру водорода рассчитаем по формуле
.
Ответ: Т = 284 К.
Пример 2. Хромирование тонкой прямоугольной пластинки длиной а = 3,0 см и шириной b = 5,0 см в большой гальванической ванне осуществляется в течение промежутка времени t = 2,0 ч при силе тока I = 1,5 А. Определите толщину образовавшегося на пластинке слоя хрома. Плотность хрома ρ = 7,18 · 103 .
Дано:
а = 3,0 см = 3,0 · 10–2 м
b = 5,0 см = 5,0 · 10–2 м
t = 2,0 ч = 7,2 · 103 с
I = 1,5 А
ρ = 7,18 · 103
h — ?
Решение: Для определения массы хрома, осаждённого на двух сторонах пластинки, воспользуемся законом Фарадея: m = kIt, где k = 1,8 ∙ 10–7 .
С другой стороны, массу хрома можно выразить через плотность ρ и объём V: m = ρV = ρab ∙ 2h , где h — толщина образовавшегося на пластинке слоя хрома. С учётом этого: 2ρabh = kIt, откуда толщина слоя хрома:
Ответ: h = 90 мкм.
Упражнение 25
1. Через водный раствор сульфата меди(II) CuSO4, находящийся в электролитической ванне, пропускают электрический ток. Определите число атомов меди, ежесекундно осаждающихся на катоде ванны, если сила тока в цепи I = 4,0 А.
2. В процессе электролиза на катоде осаждается двухвалентный никель, образуя слой массой m = 0,15 кг. Определите работу, совершённую электрическим током, если напряжение между электродами электролитической ванны U = 4,0 В.
3. Электроды, находящиеся в растворе сульфата меди(II) CuSO4, подключены к источнику тока с ЭДС = 12 В и внутренним сопротивлением r = 0,40 Ом. Определите массу меди, осаждённой на катоде за промежуток времени t = 10 мин, если сопротивление раствора между электродами R = 0,60 Ом.
4. При электролизе слабого раствора серной кислоты на катоде электролитической ванны выделился газообразный водород, температура которого t = 22 ºС, давление р = 100 кПа и объём V = 1,5 л. Электролиз проходил при напряжении U = 6,0 В, а коэффициент полезного действия установки η = 75 %. Определите расход электроэнергии.
5. Воздушный шар наполнен водородом, сохраняющим тепловое равновесие с атмосферным воздухом. Небольшое отверстие в нижней части шара обеспечивает практически одинаковое давление газа внутри шара и атмосферного воздуха. Масса тонкой оболочки шара и поднимаемого им груза m = 2,2 · 102 кг. Какой электрический заряд при электролизе потребовалось бы пропустить через слабый раствор серной кислоты, чтобы получить необходимую массу водорода? Как долго продолжался бы такой процесс при силе тока I = 0,15 кА? (Ответ: q ≥ 1,6 · 109 Кл; τmin = 4,1 месяца.)
From Wikipedia, the free encyclopedia
The Electrochemical equivalent, sometimes abbreviated Eq or Z, of a chemical element is the mass of that element (in grams) transported by 1 coulomb of electric charge. The electrochemical equivalent of an element is measured with a voltameter.
Definition[edit]
The electrochemical equivalent of a substance is the mass of the substance deposited to one of the electrodes when a current of 1 ampere is passed for 1 second, i.e. a quantity of electricity of one coulomb is passed.
The formula for finding electrochemical equivalent is as follows:
where 




Eq values of some elements in kg/C[edit]
| Element | Electrochemical equivalent |
|---|---|
| Silver (Ag) | 1.118×10^(-6)
0.000118gm/c |
| Copper (Cu) | 3.295×10^(-7) |
| Gold (Au) | 6.812×10^(-7) |
| Iron (Fe) | 2.894×10^(-7) |
| Zinc (Zn) | 1.58×10^(-7) |
| Hydrogen (H2) | 1.044×10^(-7) |
| Sodium (Na) | 2.387×10^(-7) |
| Potassium (K) | 4.055×10^(-7) |
| Oxygen (O2) | 8.28×10^(-8) |
| Aluminum (Al) | 9.36×10^(-8) |
References[edit]
Электрохими́ческий эквивале́нт — отношение массы вещества, выделившегося на гальваническом электроде при электролизе, к количеству электричества, прошедшего через электролит.
В Международной системе единиц (СИ) электрохимический эквивалент выражается в кг/Кл.
Так как согласно первому закону Фарадея при электролизе масса вещества m, участвующего в электродном процессе, пропорциональна количеству пропущенного электричества Q

то электрохимический эквивалент численно равен коэффициенту пропорциональности (k) в уравнении этого закона.
Согласно второму закону Фарадея электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:

где F = 96 485,33289 Кл/Моль — постоянная Фарадея, а 

где 
| Химический элемент |
молярная масса (г/моль) |
изменение валентности Z |
1/ZF (мкмоль/кулон) |
эл/химический эквивалент (мг/кулон) |
эл/химический эквивалент (г/Ампер-час) |
Пример применения |
| Водород | 1,0079 | 1 — 0 | 10,364 | 0,0104 | 0,0376 | электролиз воды |
| Кислород | 15,999 | 2 — 0 | 5,1821 | 0,0829 | 0,298 | |
| Фтор | 18,998 | 1 — 0 | 10,364 | 0,197 | 0,709 | производство фтора |
| Натрий | 22,99 | 1 — 0 | 10,364 | 0,238 | 0,858 | производство натрия |
| Алюминий | 26,981 | 3 — 0 | 3,4548 | 0,0932 | 0,336 | производство алюминия |
| Хлор | 35,451 | 1 — 0 | 10,364 | 0,367 | 1,32 | электролиз хлорида натрия |
| Хром | 51,996 | 6 — 3 или 3 — 0 | 3,4548 | 0,18 | 0,647 | |
| Хром | 51,996 | 6 — 0 | 1,7274 | 0,0898 | 0,323 | |
| Марганец | 54,938 | 4 — 3 или 3 — 2 | 10,364 | — | — | щелочной элемент |
| Марганец | 54,938 | 4 — 2 или 2 — 0 | 5,1821 | 0,285 | 1,02 | |
| Марганец | 54,938 | 7 — 4 или 3 — 0 | 3,4548 | 0,19 | 0,683 | |
| Марганец | 54,938 | 7 — 0 | 1,4806 | 0,0813 | 0,293 | |
| Железо | 55,845 | 03.фев | 10,364 | — | — | |
| Железо | 55,845 | 2 — 0 | 5,1821 | 0,289 | 1,04 | |
| Железо | 55,845 | 3 — 0 | 3,4548 | 0,193 | 0,695 | |
| Никель | 58,693 | 2 — 0 | 5,1821 | 0,304 | 1,09 | |
| Кобальт | 58,933 | 2 — 0 | 5,1821 | 0,305 | 1,1 | |
| Медь | 63,546 | 2 — 1 или 1 — 0 | 10,364 | 0,659 | 2,37 | |
| Медь | 63,546 | 2 — 0 | 5,1821 | 0,329 | 1,19 | рафинирование меди |
| Цинк | 65,409 | 2 — 0 | 5,1821 | 0,339 | 1,22 | |
| Родий | 102,91 | 3 — 0 | 3,4548 | 0,356 | 1,28 | |
| Палладий | 106,42 | 2 — 0 | 5,1821 | 0,552 | 1,99 | |
| Серебро | 107,87 | 1 — 0 | 10,364 | 1,12 | 4,02 | |
| Кадмий | 112,41 | 2 — 0 | 5,1821 | 0,583 | 2,1 | |
| Олово | 118,71 | 4 — 2 или 2 — 0 | 5,1821 | 0,615 | 2,21 | |
| Олово | 118,71 | 4 — 0 | 2,5911 | 0,308 | 1,11 | |
| Платина | 195,08 | 2 — 0 | 5,1821 | 1,01 | 3,64 | |
| Золото | 196,97 | 1 — 0 | 10,364 | 2,04 | 7,35 | Au(I) |
| Золото | 196,97 | 3 — 0 | 3,4548 | 0,68 | 2,45 | |
| Свинец | 207,2 | 4 — 2 или 2 — 0 | 5,1821 | 1,07 | 3,87 | свинцово-кислотный аккумулятор |
| Свинец | 207,2 | 4 — 0 | 2,5911 | 0,537 | 1,93 |
2. Электрохимический эквивалент.
Электрохимический эквивалент представляет собой количество вещества, прореагировавшего в результате протекания единицы количества электричества.
Электрохимический эквивалент может быть получен расчетным путем, если известна электрохимическая реакция, т.е. исходные вещества и ее продукты. Уравнение для расчета электрохимического эквивалента выглядит следующим образом:

где М – молярная масса реагента, n – число электронов, участвующих в реакции, F – число или постоянная Фарадея: F = 96486 ≈96500 Кл/моль.
Количественные соотношения при электролизе
Количественные расчеты процессов
электролиза осуществляются на основании
законов М. Фарадея.
Первый закон Фарадея.
Масса вещества, выделяющегося на
электроде при электролизе, пропорциональна
количеству прошедшего через раствор
электричества.
m
= k
· Q,
где m– масса восстановленного или
окисленного вещества (г);k–
коэффициент пропорциональности
(электрохимический эквивалент) (г/Кл);
Q– количество электричества, прошедшего
через электролит (Кл).
Напомним, что кулон (Кл) – количество
электричества, проходящее по проводнику
при силе тока 1 ампер (А) за время 1 с.
Количество электричества Qрассчитывается как произведение силы
тока I в амперах на времяtв секундах.
Q
= I
· t.
Электрохимический эквивалент (k)
представляет собой массу вещества,
которая восстанавливается на катоде
или окисляется на аноде при прохождении
через раствор 1 Кл электричества. Величину
электрохимического эквивалента можно
рассчитать по формуле:
k
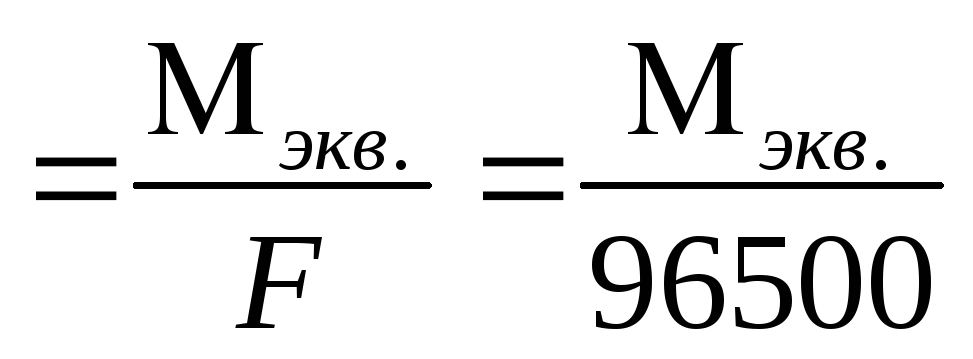
где Mэкв. – молярная масса
эквивалента этого вещества (г/моль);F– постоянная Фарадея.
Постоянная Фарадея представляет собой
количество электричества, необходимое
для выделения из раствора 1 моль
эквивалентов вещества (F = 96500 Кл/моль).
Это количество электричества равно
заряду 1 моль (6,02 ∙ 1023)
электронов.
Молярная масса эквивалента для элемента,
в свою очередь, может быть найдена как
частное от деления молярной массы
элемента на его валентность:
Mэкв =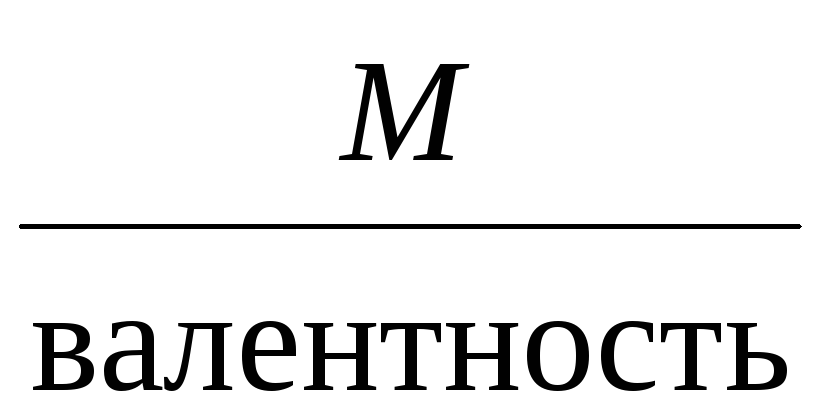
Например, молярные массы эквивалентов
для серебра, меди и алюминия будут,
соответственно, равны:
Mэкв(Ag) =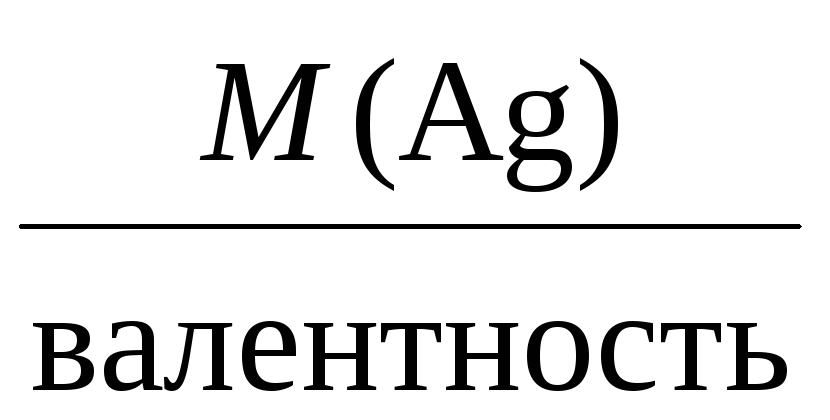
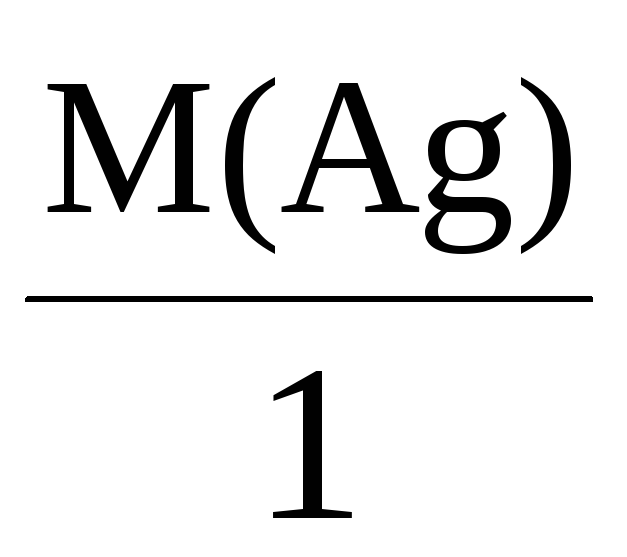
= 108 г/моль,
Mэкв(Ag) =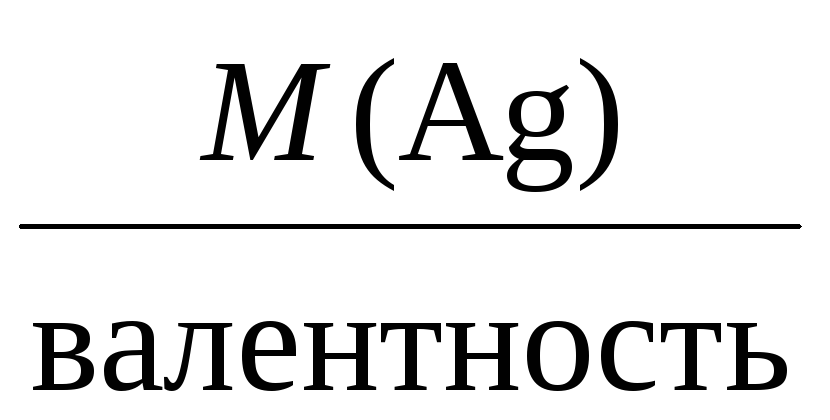
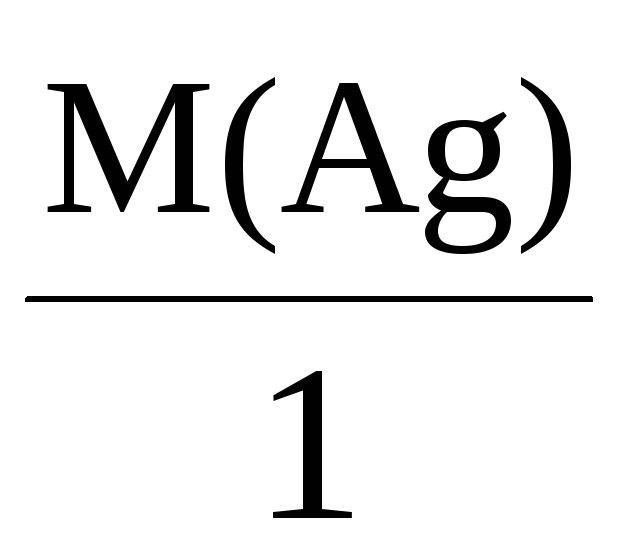
= 108 г/моль,
Mэкв(Cu) =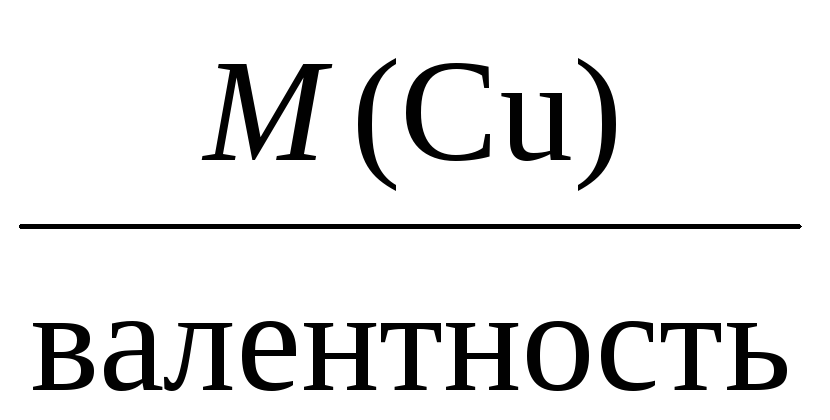
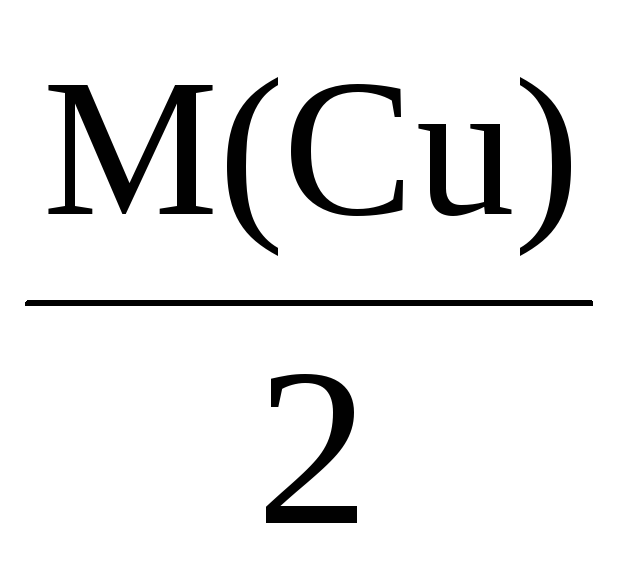
= 32 г/моль,
Mэкв(Al) =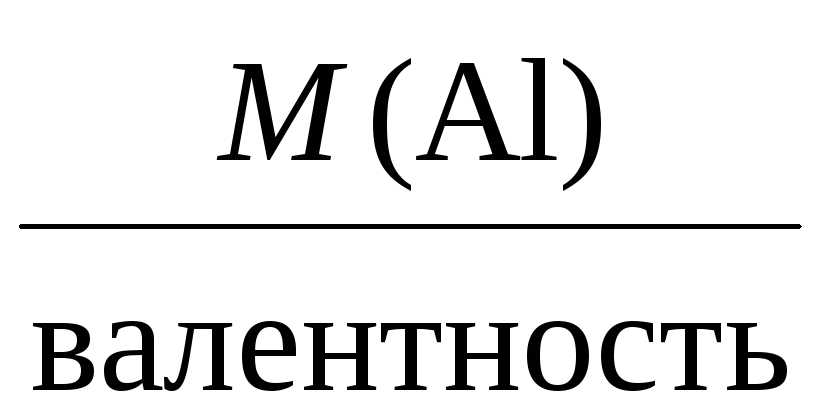
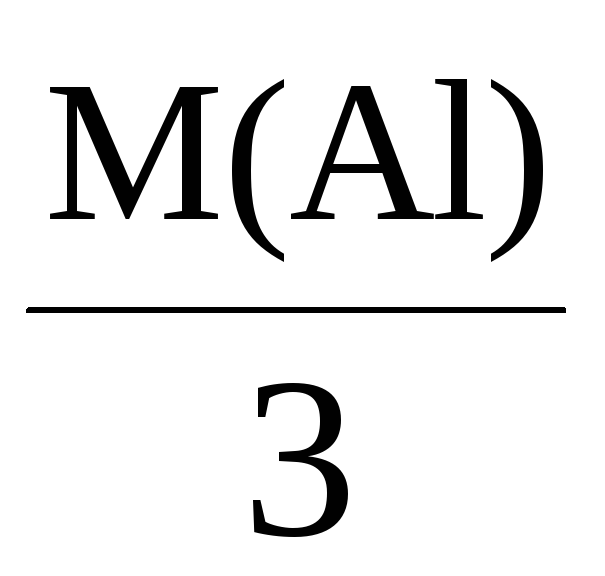
= 9 г/моль.
При пропускании через раствор 96500 Кл
электричества на катоде выделится,
соответственно, 108 г серебра, 32 г меди
или 9 г алюминия.
Таким образом, при количественных
расчетах процесса электролиза можно
пользоваться следующими формулами:
m=k
· Q=k
∙ I ·
τ,
m=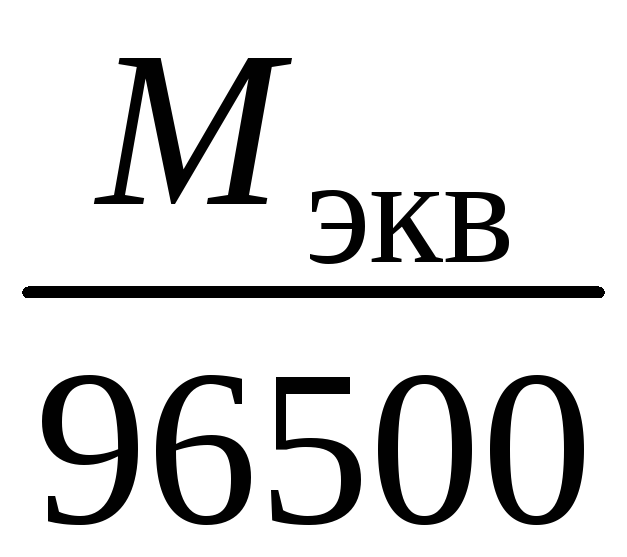
τ.
Второй закон Фарадея.
Массы окисляющихся и восстанавливающихся
на электродах веществ, при пропускании
через раствор одного и того же количества
электричества, пропорциональны молярным
массам их эквивалентов.
Полезно иметь в виду, что если для разряда
одного однозарядного иона (например,
Na+, Cl–) требуется 1 электрон,
то для выделения из раствора электролита
1 моль таких же ионов, требуется число
электронов, равное числу Авогадро –
6,02·1023(1 моль электронов). Это
количество электронов как раз и имеет
общий заряд, равный 96500 Кл. Соответственно,
для разряда 1 моль двухзарядных ионов,
потребуется 2 моль электронов, или
количество электричества, равное 2
· 96500 Кл и т.д.
Используя вышеприведенные формулы,
можно производить ряд расчетов, связанных
с процессом электролиза, например:
вычислять количества веществ,
выделяемых или разлагаемых определенным
количеством электричества;
находить силу тока по количеству
выделившегося вещества и времени,
затраченному на его выделение;
устанавливать, сколько времени
потребуется для выделения определенного
количества вещества при заданной силе
тока.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #