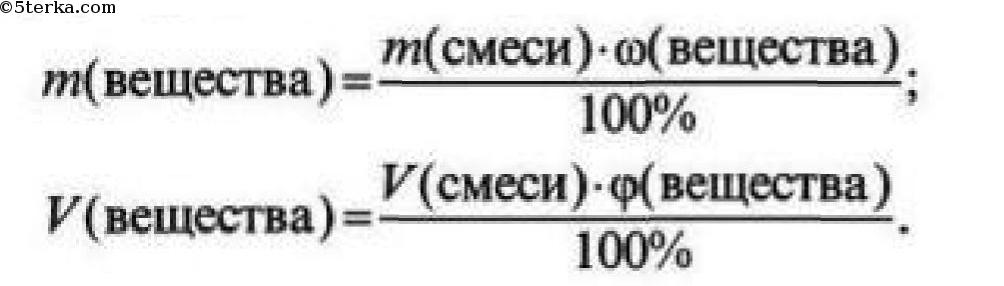Каждое вещёство наряду с основным компонентом включает то или иное количество примесей. Именно поэтому абсолютно чистых веществ в природе не существует.
Образец (вещество, навеску), содержащий примеси, принято называть техническим (технически чистым). Его массу обозначают mтехн, массу примесей — mприм, а массу основного (чистого) вещества — mчист.
Обрати внимание!
(=) mчист (+)
mприм
.
Содержание примесей в техническом образце обычно указывается с помощью массовой доли, которую выражают в долях от единицы или в процентах:
Сумма массовых долей примесей
ωприм
и основного вещества
ωчист
равна (1) ((100) %):
(+) ωчист (=) (1) ((100) %).
При проведении расчётов по уравнениям химических реакций, если исходное вещество содержит определённую долю примесей, придерживаются алгоритма:
1. если необходимо, записывают уравнение химической реакции.
2. Находят массу чистого вещества.
Её можно рассчитать по формуле:
mчист (=) mтехн (·) ωчист (=) mтехн (·) ((1 -) ωприм )
— либо используя пропорцию. При этом mтехн соответствует (100) %, а mчист — (x) %.
3. Определяют химическое количество чистого вещества по формуле:
n=mM.
4. Подчёркивают формулы интересующих веществ в уравнении реакции.
Под этими формулами записывают химические количества вступивших в реакцию и образовавшихся веществ (коэффициенты перед веществами в уравнении реакции). Над формулами веществ указывают известную величину (найденное по формуле химическое количество чистого вещества), а также неизвестную, которую обозначают за (x) — (химическое количество образующегося продукта реакции или вступившего в реакцию исходного вещества).
5. Составляют пропорцию и находят неизвестную величину.
6. Если необходимо, рассчитывают по формуле массу продукта реакции или массу вступившего в реакцию вещества:
m=n⋅M.
Обрати внимание!
Если необходимо найти объём газообразного вещества ( при н. у.) — используют формулу: V(вещ)=Vm⋅n(вещ); Vm=22,4 л/моль.
Вычисли массу негашёной извести
CaO
, которую получили при обжиге известняка массой (300) г, если массовая доля примесей в нём равна (0,08) ((8) %).
1. Запиши уравнение химической реакции:
2. Определи массовую долю чистого карбоната кальция в известняке и найди массу соли:
ωчист (=) (1) (-) ωприм (= 1 — 0,08 = 0,92).
(0,92) — массовая доля (в долях от единицы) карбоната кальция в известняке.
mчист (=) mтехн (·) ωчист (= 300 · 0,92 = 276) г.
(276) г — масса чистого карбоната кальция в известняке.
3. Определи химическое количество чистого вещества:
моль.
4. (2,76) моль (x) моль
(1) моль (1) моль
5. Составь пропорцию и найди неизвестную величину:
(2,76) моль — химическое количество образовавшейся негашёной извести.
6. Определи массу негашёной извести:
г.
Ответ: (m()CaO()) (=) (154,56) г.
I.
Определение массы (объема) вещества по
известной массе другого вещества, содержащего определенную долю примесей.
Помните: 1.Особенность данного типа задач в том, что сначала
необходимо вычислить массу чистого вещества в смеси.
2. В условии
задачи в роли смеси может выступать руда, технический образец вещества, раствор.
Порядок решения задачи:
1) Прочитайте задачу, запишите краткое условие.
2)
Определите
массу чистого вещества по формуле: mв-ва= mсмеси * ωв-ва.
3) Напишите уравнение реакции.
4) Найдите количества веществ, данных в задаче,
по уравнению и по условию.
5) Произведите необходимые расчёты и запишите
ответ.
Образец решения:
Рассчитайте объем водорода, выделившегося при взаимодействии с соляной
кислотой 325 г цинка, содержащего 20% примесей.
Д
а н о:
Р е ш е н и е:
mтехнич.(Zn)= 325 г
1) mтехнич.(Zn)=
325 г ω (Zn)= 100%-20%=80% (0,8);
ωприм.=
20% (0,2) m (Zn)=
325 * 0,8 = 260 г
V(Н2)= ?
n (Zn)
= 260г : 65 г/моль = 4 моль.
по условию:
4
моль Х
моль
2)
Zn
+ 2HCl = ZnCl2 +
H2
: 1 моль
1 моль
Х= 4 моль
V(Н2) = Vm * n(Н2); V(Н2) = 22,4 л/моль * 4 моль =
89,6 л.
Ответ: V(Н2) =89,6 л.
Алгоритм
решения задач на примеси.
II.
Определение массовой доли примесей (или
массовой доли чистого вещества в смеси) по массе (объёму) продуктов реакции.
Помните: 1) сначала выполняются действия по уравнению
реакции;
2) для
определения массовой доли примесей применяем формулу:
ωприм.
= mприм./mсмеси.
Порядок решения задачи:
1) Прочитайте задачу, запишите краткое условие.
2) Составьте уравнение химической реакции.
3) Рассчитайте массу чистого вещества,
необходимого для реакции по уравнению реакции.
4) Вычислите массу примесей в образце по условию.
5) Вычислите массовую долю примесей по формуле: ωприм.
= mприм./mсмеси.
Образец решения:
Определите массовую долю примесей в техническом образце карбида
кальция, если из 200 г его получили 56 л ацетилена.
Д
а н о: Р е ш
е н и е: пусть х г – масса чистого
вещества
CaC2.
mтехнич.(CaC2)=200г
1)по условию: х г 56л
V(С2Н2)
= 56 л
CaC2
+
2Н2О = С2Н2 + Са(ОН)2
ωприм = ?
1 моль 1 моль
М=64г/моль Vm=22.4л/моль
по уравнению: m=64 г V= 22,4 л ,
тогда х г/64 г= 56 л/22,4 л;
х = 160 г.
2) определяем массу примесей в образце:
mприм.= 200 – 160 = 40 г.
3) определяем массовую долю примесей:
ωприм = 40 г/ 200 г = 0,2 (или 20%).
Ответ: ωприм =
20%.
№3. Доля (массовая или объемная) примесей — это безразмерная величина, которая показывает отношение массы (объема) примесей к общей массе (объему) смеси.
Чтобы найти массу (объем) чистого вещества, если известна массовая (объемная) доля примесей, необходимо:
1) из 100% вычесть массовую (объемную) долю примесей и найти массовую (объемную) долю чистого вещества;
2) по формуле рассчитать массу (объем) чистого вещества:
Источник:
Решебник
по
химии
за 11 класс (О.С. Габриелян, 2007 год),
задача №3
к главе «§12 Состав вещества. Смеси».
Все задачи
← 2 Что называют массовой (объемной) долей компонента смеси? Как ее рассчитывают?
4 Не производя расчета, укажите, в каком из оксидов, формулы которых Fe2O3 и Fe3O4, содержание железа выше. Ответ подтвердите расчетами. →
Комментарии
Как найти массу чистого вещества
Абсолютно чистых веществ не бывает, любое всегда содержит какое-то количество примесей. Это содержание может быть весьма большим, может быть очень малым, но примеси все равно есть. А можно ли найти массу чистого вещества?

Инструкция
Согласно принятым нормам, любая химическая продукция, выпущенная на государственных или частных предприятиях, должна иметь сертификат качества, в котором указано процентное содержание основного вещества и наиболее значимых примесей. Это определяется лабораторным путем с помощью методов качественного и количественного анализа. Сертификат прилагается к любой конкретной партии продукции, а его основные показатели должны быть отражены на каждой единице упаковки.
Например, хорошо известная поваренная соль — хлористый натрий. Покупая упаковку марки «Экстра» массой 1 килограмм, сколько чистой соли вы приобретаете? Посмотрите на информацию с упаковки. Если содержание основного вещества 99,7%, это очень хороший показатель, что неудивительно, поскольку «экстра» означает высокую степень очистки. Следовательно, чистого вещества в единице упаковки содержится: 1000*0,997=997 грамм. Остальные три грамма распределятся между различными примесями. Разумеется, в других, менее очищенных сортах поваренной соли, содержание чистого вещества будет ниже.
Или вот задача, которая наверняка заинтересует прекрасный пол. Предположим, имеется золотое кольцо 585-й пробы, массой 20 грамм. Сколько чистого золота оно содержит? Дать ответ на этот вопрос очень просто, достаточно лишь вспомнить, каков смысл понятия «проба». В России ее величина указывает, какова доля чистого благородного металла в 1000 весовых долей изделия. Следовательно, 585-я проба соответствует концентрации, равной 58,5%. Произведите вычисление в одно действие: 20*0,585=11,7 грамма. Именно столько чистого золота содержится в кольце.
А как быть, к примеру, если кольцо работы английского мастера, и весит те же 20 грамм, но на клейме вместо пробы указано что-то непонятное — «18К»? Как в таком случае найти количество чистого золота в изделии? И тут нет абсолютно ничего сложного. Дело в том, что в Великобритании принята «каратная» шкала чистоты благородных металлов. Наивысшей теоретически, 100% концентрации, соответствует 24 карата. Тогда изделие было бы промаркировано «24К». Раз стоит клеймо «18К», это значит, что в изделии 18 весовых частей золота, и 6 весовых частей примесей. Разделите: 18/24=0,75. Изделие соответствует вашей 750-й пробе. Произведите вычисление: 20*0,75=15 грамм. Вот сколько чистого золота содержится в этом кольце.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Очень часто при проведении реакции между веществами оказывается, что один реагент прореагировал полностью, а другой нет. В таком случае говорят, что вещество, которое полностью израсходовалось, было в недостатке, а то вещество, которое осталось – в избытке. Поскольку избыток реагента не участвует в реакции, количество продукта зависит только от количества вещества, которое было в недостатке.
Предположим, что осуществляется реакция между веществами А и B, которая протекает в соответствии с уравнением:
aA + bB = cC + dD
Для осуществления этой реакции было взято количество вещества A, равное nA, и количество вещества B, равное nB. Определить то, какое вещество в избытке, а какое в недостатке, можно, сравнив выражения:
В зависимости от того, какое выражение окажется меньше, то вещество соответственно и будет в недостатке.
Примечание: распространенной ошибкой является то, что вместо выражений (1) сравнивают просто количества веществ. Так делать категорически не допускается! Если n(A) > n(B), то это еще не значит, что вещество A в избытке!
После того, как будет установлено то, какое вещество было в недостатке, расчеты ведутся по его количеству аналогично рассмотренным в главе 4.3.3.
Пример задачи на избыток и недостаток
Нагрели смесь 54 г алюминия и 80 г серы. Вычислите массу образовавшегося сульфида алюминия.
Решение
Запишем уравнение реакции:
2Al + 3S = Al2S3
Рассчитаем количества веществ алюминия и серы:
n(Al) = m(Al)/M(Al) = 54/27 = 2 моль;
n(S) = m(S)/M(S) = 80/32 = 2,5 моль
Для того чтобы выяснить, какое из исходных веществ в недостатке, разделим количества молей веществ на коэффициенты перед этими веществами в уравнении и сравним рассчитанные выражения:
n(Al)/k(Al) = 2/2 = 1
и n(S)/k(S) = 2,5/3 ≈ 0,833
т.е. n(Al)/k(Al) > n(S)/k(S)
Значит сера в недостатке. Расчеты далее ведем по количеству вещества серы.
Исходя из уравнения реакции
2Al + 3S = Al2S3
следует, что количество прореагировавшей серы и образовавшегося в результате реакции сульфида алюминия связаны выражением:
где 3 и 1 – коэффициенты перед S и Al2S3 соответственно. Отсюда:
n(Al2S3) = n(S)/3 = 2,5/3 ≈ 0,8333 моль
Следовательно, масса сульфида алюминия будет равна:
m(Al2S3) = M(Al2S3) ∙ n(Al2S3) = 150 ∙ 0,8333 = 125 г
Ответ: m(Al2S3) = 125 г
В случае, если в задаче дается масса реагента, содержащего примеси (mр-та с прим.), прежде всего следует рассчитать массу чистого реагента без примесей (mр-та ). Если дается масса реагента с примесями и указана массовая доля этого реагента ωр-та , то масса чистого реагента рассчитывается по формуле:
В случае, если вместо массовой доли чистого вещества дается массовая доля примесей, то учитывая, что:
ωр-та + ωприм. = 100%
мы можем записать, что:
Пример задачи на расчет количества продукта, зная массу реагента с примесями
Какой объем углекислого газа (н.у.) выделится при действии избытка соляной кислоты на технический карбонат кальция массой 150 г, содержащий 10% некарбонатных примесей.
Решение:
Запишем уравнение взаимодействия карбоната кальция с соляной кислотой:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Массовая доля примесей в техническом карбонате кальция составляет 10%, значит массовая доля чистого карбоната кальция будет составлять:
ω(CaCO3) = 100% — ω(прим.) = 100% — 10% = 90%.
Масса чистого карбоната кальция будет равна:
m(CaCO3) = ω(CaCO3) ∙ m(CaCO3 техн.)/100% = 90% ∙ 150 г/100% = 135 г,
Следовательно, количество вещества карбоната кальция равно:
n(CaCO3) = m(CaCO3)/M(CaCO3) = 135 г / 100 г/моль = 1,35 моль
В соответствии с уравнением реакции:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Количества веществ карбоната кальция и углекислого газа равны (одинаковые коэффициенты в уравнении), следовательно:
n(CO2) = n(CaCO3) = 1,35 моль
Тогда, зная, что один моль любого газа при нормальных условиях занимает объем 22,4 л, мы можем рассчитать объем выделившегося CO2:
V(CO2) = n(CO2) ∙ Vm = 1,35 моль ∙ 22,4 л/моль = 30,24 л
Автор: С.И. Широкопояс https://scienceforyou.ru/