Температура
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: тепловое равновесие, абсолютная температура.
Мы часто используем слово «температура» в повседневной речи. А что такое температура? В данной статье мы объясним физический смысл этого понятия.
В молекулярной физике и термодинамике рассматриваются макроскопические тела, т. е. тела, состоящие из огромного числа частиц. Например, в стакане воды содержится порядка молекул. Такое грандиозное число с трудом поддаётся осмыслению.
Термодинамическая система
Термодинамической системой называется макроскопическое тело или система тел, которые могут взаимодействовать друг с другом и с окружающими телами. Стакан с водой — пример термодинамической системы.
Термодинамическая система состоит из столь большого числа частиц, что совершенно невозможно описывать её поведение путём рассмотрения движения каждой молекулы в отдельности. Однако именно грандиозность числа молекул делает ненужным такое описание.
Оказывается, что состояние термодинамической системы можно характеризовать небольшим числом макроскопических параметров — величин, относящимся к системе в целом, а не к отдельным атомам или молекулам. Такими макроскопическими параметрами являются давление, объём, температура, плотность, теплоёмкость, удельное сопротивление и др.
Состояние термодинамической системы, при котором все макроскопические параметры остаются неизменными с течением времени, называется тепловым равновесием. В состоянии теплового равновесия прекращаются все макроскопические процессы: диффузия, теплопередача, фазовые переходы химические реакции и т. д.(Следует отметить, что тепловое равновесие является динамическим равновесием. Так, при тепловом равновесии жидкости и её насыщенного пара весьма интенсивно идут взаимные превращения жидкости и пара. Но это — процессы молекулярного масштаба, они происходят с одинаковыми скоростями и компенсируют друг друга. На макроскопическом уровне количество жидкости и пара со временем не меняется).
Термодинамическая система называется изолированной, если она не может обмениваться энергией с окружающими телами. Чай в термосе — типичный пример изолированной системы.
Тепловое равновесие
Фундаментальный постулат, вытекающий из многочисленных опытных данных, гласит: каково бы ни было начальное состояние тел изолированной системы, со временем в ней устанавливается тепловое равновесие. Таким образом, тепловое равновесие — это состояние, в которое любая система, изолированная от окружающей среды, самопроизвольно переходит через достаточно большой промежуток времени.
Температура как раз и является величиной, характеризующей состояние теплового равновесия термодинамической системы.
Температура — это макроскопический параметр, значения которого одинаковы для всех частей термодинамической системы, находящейся в состоянии теплового равновесия. Попросту говоря, температура — это то, что является одинаковым для любых двух тел, которые находятся в тепловом равновесии друг с другом. При тепловом контакте тел с одинаковыми температурами между ними не будет происходить обмен энергией (теплообмен).
В общем же случае при установлении между телами теплового контакта теплообмен начнётся. Говорят, что тело, которое отдаёт энергию, имеет более высокую температуру, а тело, которое получает энергию — более низкую температуру. Температура, таким образом, указывает направление теплообмена между телами. В процессе теплообмена температура первого тела начнёт уменьшаться, температура второго тела — увеличиваться; при выравнивании температур теплообмен прекратится — наступит тепловое равновесие.
Особенность температуры заключается в том, что она не аддитивна: температура тела не равна сумме температур его частей. Этим температура отличается от таких физических величин, как масса, длина или объём. И по этой причине температуру нельзя измерить путём сравнения с эталоном.
Измеряют температуру с помощью термометра.
Для создания термометра выбирают какое-либо вещество (термометрическое вещество), какую-либо характеристику этого вещества (термометрическую величину), и используют зависимость термометрической величины от температуры. При этом выбор термометрического вещества и термометрической величины может быть весьма произвольным.
Так, в бытовых жидкостных термометрах термометрическим веществом является ртуть (или спирт), а термометрической величиной — длина столбика жидкости. Здесь используется линейная зависимость объёма жидкости от температуры.
В идеально-газовых термометрах используется линейная зависимость давления разреженного газа (близкого по своим свойствам к идеальному) от температуры.
Действие электрических термометров (термометров сопротивления) основано на температурной зависимости сопротивления чистых металлов, сплавов и полупроводников.
В процессе измерения температуры термометр приводится в тепловой контакт(В области температур выше (раскалённые газы, расплавленные металлы) используются бесконтактные высокотемпературные термометры — пирометры. Их действие основано на измерении интенсивности теплового излучения в оптическом диапазоне.) с телом, температура которого определяется. Показания термометра после наступления теплового равновесия — это и есть температура тела. При этом термометр показывает свою температуру!
Температурная шкала. Абсолютная температура
При установлении единицы температуры чаще всего поступают следующим образом. Берут две температуры (так называемые реперные точки) — температуру таяния льда и температуру кипения воды при нормальном атмосферном давлении. Первой температуре приписывают значение , второй — значение
, а интервал между ними делят на
равных частей. Каждую из частей называют градусом (обозначают
), а полученную таким образом температурную шкалу — шкалой Цельсия.
При измерениях по шкале Цельсия с помощью жидкостных термометров возникает одна трудность: разные жидкости при изменении температуры изменяют свой объём по-разному. Поэтому два термометра с различными жидкостями, приведённые в тепловой контакт с одним и тем же телом, могут показать разные температуры. От данного недостатка свободны идеально-газовые термометры — зависимость давления разреженного газа от температуры не зависит от вещества самого газа.
Кроме того, для температурной шкалы идеально-газового термометра существует естественное начало отсчёта (исчезает произвол выбора реперной точки!): это та предельно низкая температура, при которой давление идеального газа постоянного объёма обращается в нуль. Эта температура называется абсолютным нулём температур.
Температурная шкала, началом отсчёта которой является абсолютный нуль, а единицей температуры — градус Цельсия, называется абсолютной температурной шкалой.
Температура, измеряемая по абсолютной шкале, называется абсолютной температурой и обозначается буквой . Единица абсолютной температуры называется кельвином (
).
Абсолютному нулю () соответствует температура
. Поэтому связь абсолютной температуры и температуры по шкале Цельсия даётся формулой:
В задачах достаточно использовать формулу
Благодарим за то, что пользуйтесь нашими материалами.
Информация на странице «Температура» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в ВУЗ или колледж нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
Температура. Тепловое равновесие. Абсолютная шкала температур. Молекулярная физика
- Подробности
- Обновлено 07.10.2018 21:52
- Просмотров: 920
Температура — это просто!
Температура
Температура — это мера средней кинетической энергии молекул.
Температура характеризует степень нагретости тел.
Прибор для измерения температуры — термометр.
Принцип действия термометра:
При измерении температуры используется зависимость изменения какого-либо макроскопического параметра (объема, давления, электрического сопротивления и т.д.) вещества от температуры.
В жидкостных термометрах — это изменение объема жидкости.
При контакте двух сред происходит передача энергии от более нагретой среды менее нагретой.
В процессе измерения температура тела и термометра приходят в состояние теплового равновесия.
Жидкостные термометры
На практике часто используются жидкостные термометры: ртутные (в диапазоне от -35oС до +750oС) и спиртовые (от -80oС до +70oС).
В них используется свойство жидкости изменять свой объем при изменении температуры.
Однако, у каждой жидкости существуют свои особенности изменения объема (расширения) при различных температурах.
В результате сравнения, например, показаний ртутного и спиртового термометров, точное совпадение будет только лишь в двух точках (при температурах 0oС и 100oС).
Этих недостатков лишены газовые термометры.
Газовые термометры
Первый газовый термометр был создан французским физиком Ж. Шарлем.
Преимущества газового термометра:
— используется линейная зависимость изменения объема или давления газа от температуры, которая справедлива для всех газов
— точность измерения от 0,003oС до 0,02oС
— интервал температур от -271oС до +1027oС.
Тепловое равновесие
При соприкосновении двух тел различной температуры происходит передача внутренней энергии от более нагретого тела менее нагретому, и температуры обоих тел выравниваются.
Наступает состояние теплового равновесия, при котором все макропараметры (объем, давление, температура) обоих тел остаются в дальнейшем неизменными при неизменных внешних условиях.
Тепловым равновесием называется такое состояние, при котором все макроскопические параметры остаются неизменными сколь угодно долго.
Состояние теплового равновесия системы тел характеризуется температурой: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Установлено, что при тепловом равновесии средние кинетические энергии поступательного движения молекул всех газов одинаковы, т.е.
Для разреженных (идеальных) газов величина
и зависит только от температуры, тогда
где k — постоянная Больцмана
Эта зависимость дает возможность ввести новую температурную шкалу абсолютную шкалу температур, не зависящую от вещества, используемого для измерения температуры.
Абсолютная шкала температур
— введена английским физиком У. Кельвином
— нет отрицательных температур
Единица абсолютной температуры в СИ: [T] = 1K (Кельвин)
Нулевая температура абсолютной шкалы — это абсолютный ноль ( 0К = -273oС ), самая низкая температура в природе. В настоящее время достигнута самая низкая температура — 0,0001К.
По величине 1К равен 1oC.
Связь абсолютной шкалы со шкалой Цельсия
Запомни! В формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t».
После введения абсолютной температуры получаем новые выражения для формул:
Средняя кинетическая энергия поступательного движения молекул
Давление газа — основное уравнение МКТ
Средняя квадратичная скорость молекул
И как следствие, закон Авогадро:
В равных объемах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Заметьте, здесь концентрация молекул также одинакова!
Молекулярная физика. Термодинамика — Класс!ная физика
Основные положения МКТ. Масса и размер молекул. Количество вещества. —
Взаимодействие молекул. Строение твердых тел, жидкостей и газов. —
Идеальный газ. Основное уравнение МКТ. —
Температура. Тепловое равновесие. Абсолютная шкала температур. —
Уравнение состояния идеального газа. —
Изопроцессы. Газовые законы. —
Взаимные превращения жидкостей и газов. Влажность воздуха. —
Твердые тела. Кристаллические тела. Аморфные тела.
Температура — термодинамическая макроскопическая характеристика, которая играет важную роль практически во всех физических процессах. В данной статье сосредоточим свое внимание на освещении вопросов, что такое абсолютная температура газа идеального и как ее можно вычислить.
Абсолютная шкала температур
Для начала познакомимся со шкалой, которая используется в физике для описания температуры. Она называется абсолютной или шкалой Кельвина. Впервые ее ввел в использование английский физик лорд Кельвин в 1848 году. При этом ученый основывался на завоевавшей популярность шкале Цельсия.
Абсолютная температура так называется потому, что она имеет нижний предел — 0 кельвин, при котором считается «замороженным» любой вид движения (на самом деле при 0 К существуют так называемые нулевые колебания). Верхнего предела у этой шкалы нет.
С градусами Цельсия C абсолютная шкала T связана следующим простым равенством:
T = C + 273,15.
В отличие от других температурных шкал, например, от шкалы Фаренгейта, кельвин имеет точно такой же масштаб, что и градус Цельсия. Последнее означает, что для перевода в абсолютную любой температуры по Цельсию достаточно добавить к ней число 273,15. Так, по шкале Кельвина вода замерзает при 273,15 К, а кипит при 373,15 К.
Краткое понятие о газе идеальном
Поскольку далее будет рассмотрена формула для определения абсолютной температуры газа идеального, то будет полезным познакомиться с этим понятием поближе. Под идеальным понимают такой газ, молекулы которого практически не взаимодействуют друг с другом, обладают большой кинетической энергией по сравнению с потенциальной, и расстояния между которыми значительно превышают их собственные размеры.
Все реальные газы проявляют поведение идеальных при небольших давлениях и высоких температурах. Примерами могут служить благородные газы, воздух, метан и другие. В то же время пар H2O даже при низких давлениях сильно отличается от идеального газа, поскольку в нем всегда присутствуют значительные водородные связи между полярными молекулами воды.
Температура абсолютная идеального газа
Существует два подхода к определению температуры в газах. Рассмотрим каждый из них.
Первый подход заключается в привлечении положений молекулярно-кинетической теории (МКТ) и физического смысла самой температуры T. Последний заключается в кинетической энергии частиц газа. Чем больше эта энергия, тем выше температура, причем зависимость является прямо пропорциональной. Используя формулу из механики для энергии кинетической и постоянную Больцмана kB можно записать следующее равенство МКТ:
m*v2/2 = 3/2*kB*T.
Где m — масса движущейся поступательно частицы. Выражая из этого равенства величину T, получаем формулу:
T = m*v2/(3*kB).
Чем меньше масса частицы и чем больше ее скорость, тем выше абсолютная температура.
Второй подход в определении величины T заключается в использовании универсального уравнения Клапейрона-Менделеева. Это уравнение было записано в XIX веке Эмилем Клапейроном (впоследствии модифицировано Д. И. Менделеевым) как результат обобщения открытых экспериментально в XVII-XIX веках газовых законов (Шарля, Гей-Люссака, Бойля-Мариотта, Авогадро). Математически универсальное уравнение записывается так:
P*V = n*R*T.
Как видно, оно связывает три основных термодинамических величины системы: давление P, объем V и температуру абсолютную T. Две другие величины, присутствующие в уравнении, — это n — количество вещества и R — газовая постоянная.
Не представляет особого труда получить формулу для температуры из Клапейрона-Менделеева закона:
T = P*V/(n*R).
В закрытой системе (n = const) температура газа прямо пропорциональна произведению объема на давление.
Пример задачи
Воздух, которым мы дышим, является смесью газов идеальных. Известно, что молярная масса воздуха составляет 29 г/моль. Необходимо определить температуру воздуха, если средняя скорость его молекул составляет 530 м/с.
Очевидно, что решение этой задачи можно получить, если воспользоваться следующим выражением:
T = m*v2/(3*kB).
Массу одной молекулы m воздуха можно получить, если поделить величину M на число Авогадро NA. Произведение же числа NA на константу Больцмана kB — это не что иное, как газовая постоянная R, которая равна 8,314 Дж/(К*моль). Учитывая эти рассуждения, получаем рабочую формулу:
T = M*v2/(3*R ) = 0,029*6002/(3*8,314) = 326,60 К.
В градусах Цельсия найденной температуре соответствует значение 53,45 oC. На нашей планете такие температуры характерны для жарких песчаных пустынь в полдень.
Содержание:
Температура:
Перед тем как, например, пойти на пляж, многие интересуются прогнозом погоды. И если ожидается температура воздуха 10 °С, то, скорее всего, планы будут изменены. А стоит ли отказываться от прогулки, если прогнозируется температура 300 К (кельвинов)? И что на самом деле вкладывают физики в понятие «температура»?
Что такое температура
Эксперименты показывают, что макроскопическая система может переходить из одного состояния в другое. Например, если в морозный день занести в комнату шарик, наполненный гелием, то гелий в шарике будет нагреваться и при этом будут изменяться давление, объем и некоторые другие параметры газа. После того как шарик пробудет в комнате некоторое время, изменения прекратятся. Один из постулатов молекулярной физики и термодинамики — его еще называют нулевое начало термодинамики — гласит: любое макроскопическое тело или система тел при неизменных внешних условиях самопроизвольно переходит в термодинамическое равновесное состояние (состояние теплового равновесия), после достижения которого все части системы имеют одинаковую температуру. Нулевое начало термодинамики фактически вводит и определяет понятие температуры.
Температура — физическая величина, характеризующая состояние теплового равновесия макроскопической системы.
Состояние теплового равновесия — это такое состояние макроскопической системы, при котором все макроскопические параметры системы остаются неизменными сколь угодно долго.
В состоянии теплового равновесия все части системы имеют одинаковую температуру; другие макроскопические параметры неизменны, но могут быть разными. Вспомните пример с шариком: после того как установится тепловое равновесие, температура окружающего воздуха и температура гелия в шарике будут одинаковыми, а давление, плотность и объем — разными.
Как работают термометры
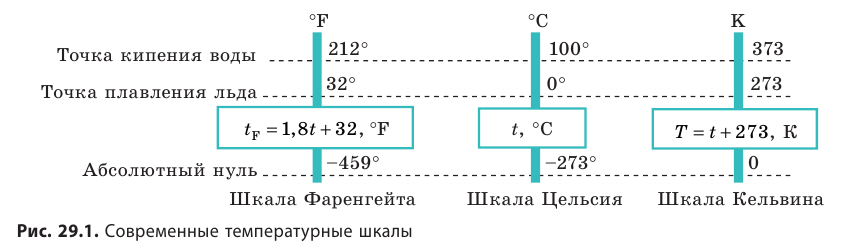
Температура — это физическая величина, и ее можно измерять. Для этого нужно установить шкалу температур. Самые распространенные температурные шкалы — шкалы Цельсия, Кельвина, Фаренгейта (рис. 29.1).
Построение шкалы температур начинается с выбора реперных (опорных) точек, которые должны быть однозначно связаны с какими-либо физическими процессами, которые легко воспроизвести. Например, за нулевую точку температурной шкалы Цельсия принята температура таяния льда при нормальном атмосферном давлении ( t = 0 °С). Температуре кипения воды при нормальном атмосферном давлении приписывают значение t =100 °С. Единица температуры по шкале Цельсия — градус Цельсия: 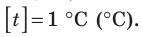
Рис. 29.2. различные виды термометров: а — жидкостный (принцип действия: изменение объема жидкости при изменении температуры); б — термометр сопротивления (изменение электрического сопротивления проводника при изменении температуры); в — биметаллический деформационный (изменение длин двух разных металлических пластин при изменении температуры)
Приборы для измерения температуры — термометры (рис. 29.2). Основные части любого термометра — термометрическое тело (ртуть или спирт в жидкостном термометре, биметаллическая пластина в металлическом деформационном термометре и т. д.) и шкала. Если термометрическое тело привести в контакт с телом, температуру которого нужно измерить, система придет в неравновесное состояние. При переходе в равновесное состояние будут изменяться некоторые параметры термометрического тела (объем, сопротивление и т. п.). Зная, как эти параметры зависят от температуры, определяют температуру тела.
Обратите внимание!
- Термометр фиксирует собственную температуру, равную температуре тела, с которым термометр находится в термодинамическом равновесии.
- Термометрическое тело не должно быть массивным, иначе оно существенно изменит температуру тела, с которым контактирует.
Температура и средняя кинетическая энергия молекул
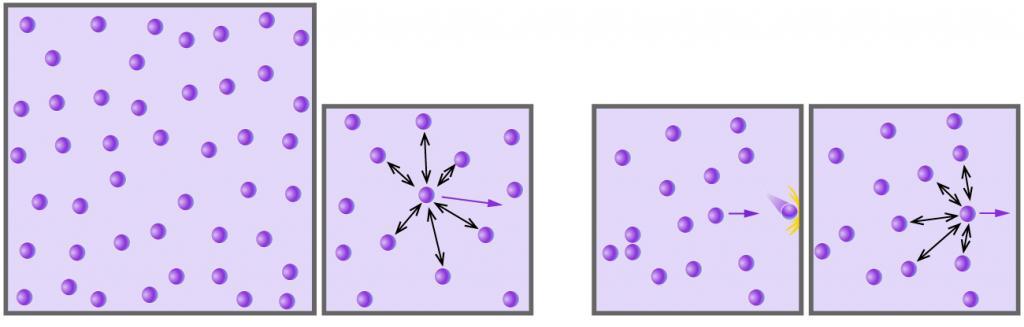
То, что температура тела должна быть связана с кинетической энергией его молекул, следует из простых соображений. Например, с увеличением температуры увеличивается скорость движения броуновских частиц, ускоряется диффузия, повышается давление газа, а это значит, что молекулы движутся быстрее и их кинетическая энергия становится больше. Можно предположить: если газы находятся в состоянии теплового равновесия, средние кинетические энергии молекул этих газов одинаковы. Но как это доказать, ведь непосредственно измерить эти энергии невозможно?
Обратимся к основному уравнению МКТ идеального газа: 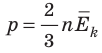
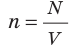
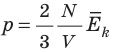
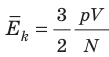
Таким образом, чтобы экспериментально убедиться в равенстве средних кинетических энергий молекул различных газов при одинаковой температуре, нужно измерить объемы (V), давления (p) и массы (m) газов и, зная их молярную массу (M), найти число молекул каждого газа (N) по формуле 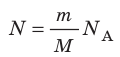
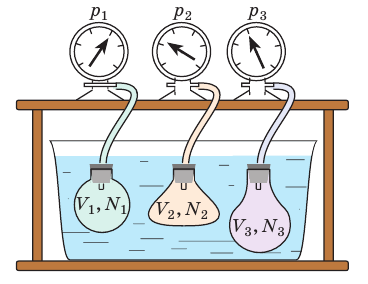
Чтобы обеспечить одинаковую температуру, можно, например, погрузить баллоны с различными газами в сосуд с водой и дождаться состояния теплового равновесия (рис. 29.3).
Рис. 29.3. опыт, позволяющий установить связь между температурой и средней кинетической энергией поступательного движения молекул газа. Газы в сосудах находятся в состоянии теплового равновесия со средой, а следовательно, и друг с другом
Эксперименты показывают, что для всех газов в состоянии теплового равновесия отношение 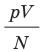
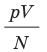
Например, при температуре 0 °С (сосуды с газами погрузили в тающий лед) 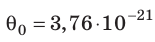
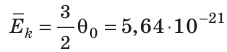
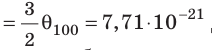
Абсолютная шкала температур
Понятно, что в джоулях представлять температуру неудобно (прежде всего потому, что значения θ очень малы), к тому же неудобно полностью отказываться от шкалы Цельсия. В 1848 г. английский физик Уильям Томсон (лорд Кельвин) (1824–1907) предложил абсолютную шкалу температур (сейчас ее называют шкалой Кельвина).
Температуру Т, измеренную по шкале кельвина, называют абсолютной температурой.
Единица абсолютной температуры — кельвин — основная единица СИ: [T] = 1 К (К).
Шкала Кельвина построена следующим образом:
- изменение температуры по шкале Кельвина равно изменению температуры по шкале Цельсия: ∆ = T t ∆ , то есть цена деления шкалы Кельвина равна цене деления шкалы Цельсия: 1 °С = 1 К; температуры, измеренные по шкалам Кельвина и Цельсия, связаны соотношениями:
- температура по шкале Кельвина связана с величиной
соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа:
- абсолютная температура имеет глубокий физический смысл: средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре:
(1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (
). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Давление p газа полностью определяется его абсолютной температурой T и концентрацией n молекул газа: p=nkT (2).
Выводы:
- Физическая величина, характеризующая состояние теплового равновесия макроскопической системы, называется температурой. Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Шкала, за нулевую точку которой взят абсолютный нуль температуры, называется абсолютной шкалой температур (шкалой Кельвина). Единица абсолютной температуры — кельвин (К) — основная единица СИ. Температуры по шкале Кельвина и Цельсия связаны соотношением: T=t + 273; t=T – 273.
- Средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре, а давление газа определяется абсолютной температурой и концентрацией молекул газа:
— постоянная Больцмана.
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Твердые тела и их свойства в физике
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
- Уравнение состояния идеального газа
Видеоурок: Абсолютная температура
Лекция: Абсолютная температура

Всегда для нас температура была характеристикой теплоты некоторого тела. На самом деле температура характеризуется скоростью движения молекул вещества, в том числе и идеального газа.
Чем большую скорость имеет молекула, следовательно, она обладает большей энергией.
Температура — это среднеквадратическая энергия структурных единиц вещества.
То есть чем больше кинетическая энергия молекул газа, тем выше температура всего вещества.
Измерять температуру можно с помощью специального проградуированного прибора. Впервые такое средство измерительной техники было предложено Фаренгейтом. За начало измерений была взята температура, при которой тает лед из воды и спирта, соединенные в равных количествах. Заканчивалась шкала температурой, при которой кипит вода. Ведь этот диапазон был разделен на 180 равных частей, каждая из которых отвечала изменению температуры на 1 градус.

Несмотря на популярность шкалы по Цельсию, за абсолютную шкалу температур во всем мире принимается шкала Кельвина, которая берет свое начало в абсолютном нуле. Абсолютный ноль — 273,15 градуса Цельсия.

Так как температура характеризуется скоростью и энергией молекул, то при абсолютном нуле все молекулы прекращают свое движение.
Абсолютная температура измеряется в Кельвинах: [Т] = 1К.
Чтобы перейти от температуры в Цельсиях к Кельвинам, следует воспользоваться простой формулой:
Например:
Если дана температура в Цельсиях 27 градусов, то чтобы перейти в Кельвины, следует просто добавить стандартную величину: 27 °С + 273 = 300 К.
Если необходимо, наоборот, перейти от Кельвинов к Цельсиям, то фиксированное значение следует отнять:
373 К — 273 = 100°С.
Данная шкала температур удобна тем, что все величины получаются положительными. Абсолютная температура не может быть отрицательной.















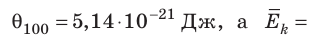
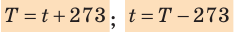
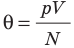 соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа:
соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа: 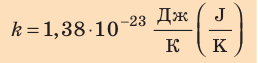
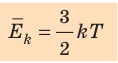 (1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (
(1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (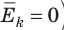 ). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.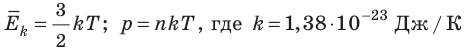 — постоянная Больцмана.
— постоянная Больцмана.
