Ответ:
Разумеется по высшей валентности.
1)Высшая валентность фосфора (P) равна 5. Что соответствует оксиду P2O5. Высшим гидроксидом неметалла является его кислота с высшей валентностью элемента в ней. То есть высший гидроксид фосфора — ортофосфорная кислота H3PO4, где фосфор проявляет валентность 5
2) то же самое с калием и магнием. Их высшая валентность равна 1 и 2 соответственно. Единственное отличие — то, что высшим гидроксидом металла является основание. Для калия — KOH, для магния — Mg(OH)2
Э(ОН)n подойдет только для 1 и 2 групп.
Далее по группам «отщепляется» вода:
3 группа(ы) (кроме таллия) Х(ОН)₃, но может быть и Х(ОН)₃ = ХООН + Н₂О
4 Х(ОН)₄ = Н₂ХО₃ + Н₂О
5 Х(ОН)₅ = Н₃ХО₄ + Н₂О или НХО₃ + 2Н₂О
6 Х(ОН)₆ = Н₂ХО₄ + 2Н₂О
7 Х(ОН)₇ = НХО₄ + 3Н₂О
Существуют еще мета- и полиформы, их формулы составляются «отнятием» или «прибавлением» к исходной формуле формулы высшего оксида. В целом, однозначного правила нет, учитывается специфика каждого элемента.
Как определить формулу высшего гидроксида?
Я видел формулу Э(ОН)n, где n это группа, но также и слышал что эти вещества не все устойчивые, например формула высшего гидроксида мышьяка H₃AsO₄, а это слабо похоже на общую формулу.
Объясните, пожалуйста как их определять.
Вопрос Как определить формулу высшего гидроксида?, расположенный на этой странице сайта, относится к
категории Химия и соответствует программе для 10 — 11 классов. Если
ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска
похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему.
Для этого ключевые фразы введите в строку поиска, нажав на кнопку,
расположенную вверху страницы. Воспользуйтесь также подсказками посетителей,
оставившими комментарии под вопросом.
stemesmex547
Вопрос по химии:
Как найти высший гидроксид
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
quitraremero171
Высший гидроксид щелочных металлов(1 группы главной подгруппы) имеет вид MeOH.
Высший гидроксид металлов 2 группы главной подгруппы имеет вид Me(OH)2, 3группы главной подгруппы Me(OH)3…
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат — это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи —
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Классификация гидроксидов и оснований
Материал по химии
Основания и гидроксиды.
Для того, чтобы разбираться в классификации, сначала нужно понять, что такое основание и чем оно отличается от других веществ. Перечислим несколько оснований:
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа
Все три примера относятся к основаниям, но в названии значится, что это гидроксиды. В чем разница между этими понятиями?
Гидроксиды – это вещества, в состав которых какой-либо элемент имеет связь с гидроксильной группой (‒ОН). Но не все гидроксиды – это основания: кислоты, например, тоже являются гидроксидами.
Классификация гидроксидов и оснований
Основные и ксилотные кидроксиды
Таким образом, все основания – это гидроксиды, но не все гидроксиды – это основания. Ввиду того, что группа гидроксидов очень разнообразна, её принято делить на три подгруппы.
Таб. «Классификация гидроксидов»
|
Гидроксид |
||
|
Основный |
Амфотерный |
Кислотный |
|
В состав входят гидроксогруппа (-ы) и металл в степени окисления «+1» или «+2» за исключением Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппы и металл в степени окисления «+3» или «+4», а также Zn(OH)2, Be(OH)2, Sn(OH)2, Pb(OH)2 |
В состав входят гидроксогруппа (-ы) и неметалл, либо гидроксогруппа (-ы) и металл в степени окисления «+5», «+6» или «+7» |
|
Общий состав: ЭОН |
Общий состав: ЭОН/НЭО |
Общий состав: НЭО |
|
Примеры: Cr(OH)2 KOH Mg(OH)2 |
Примеры: Cr(OH)3/HCrO2 Mn(OH)4/H2MnO3 Al(OH)3/HAlO2 |
Примеры: HNO3 H3PO4 HMnO4 |
Э – элемент. К основным гидроксидам так же относят гидроксид аммония – NH4OH, хотя правильнее его записывать как гидрат аммония – NH3·H2O.
Амфотерные гидроксиды имеют промежуточный характер между основными и кислотными, поэтому имеют обе формы написания.
Задание в формате ЕГЭ с ответом:
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: амфотерного гидроксида, двухосновного основания, кислотного гидроксида. Запишите соответствующую последовательность цифр.
1) NaOH 2) NH3*H2O 3) HMnO4 4) Be(OH)2 5) KMnO4 6) Na[Al(OH)4] 7) MnO2 Ca(OH)2
9) KOH
Пример задания из КИМ ЕГЭ:
Среди перечисленных веществ выберите три формулы, соответствующие амфотерным гидроксидам:
- H2Cr2O7
- Be(OH)2
- Al(OH)3
- Fe(OH)2
- Ga(OH)3
- H2SO4
Задание по образцу ФИПИ:
Кислотный гидроксид может образовать следующий элемент:
- натрий
- мышьяк
- алюминий
- хлор
- молибден
- цинк
Кислотные гидроксиды образуют неметаллы в любой степени окисления, поэтому подходит мышьяк и хлор, а также металлы в степени окисления +5 и выше, поэтому подходит молибден – он находится в шестой группе Периодической системы, значит, может образовать ион со степенью окисления +6
Перевод формулы амфотерного гидроксида из основной формы в кислотную.
Пример 1.
-
Возьмём любой амфотерный гидроксид: Al(OH)3;
-
Поменяем порядок элементов на кислотную форму (водород → элемент → кислород) без учета индексов основной формы: HAlO;
-
Расставим степени окисления:
-
Молекула должна быть электронейтральной (количество положительных и отрицательных зарядов должно быть равным), для этого кислорода должно быть в два раза больше, поэтому после него ставим индекс «2»: HAlO2
Пример 2.
-
Zn(OH)2;
-
HZnO
-
Согласно этой формуле после кислорода придется поставить индекс «1,5», но индексы могут быть выражены только целыми числами, поэтому сначала приведем количество положительных зарядов к четному значению, домножив элемент с нечетной степенью окисления (водород) на 2, получим формулу: H2ZnO, она пока всё равно не является электронейтральной, сумма её зарядов может быть выражена следующим уравнением: +2+2‒2 = +2, а должно быть = 0
|
+ |
+2 |
‒2 |
|
H2 |
Zn |
O |
|
+2 |
+2 |
‒2 |
|
+4 |
‒2 |
Чтобы количество отрицательных зарядов тоже стало равно четырем, количество кислорода нужно умножить вдвое, поставив после него индекс «2». Получается формула H2ZnO2
Таб. «Общие формулы амфотерных гидроксидов в зависимости от степени окисления металла в них»
|
Степень окисления |
+2 |
+3 |
+4 |
|
Основная формула |
Me(OH)2 |
Me(OH)3 |
Me(OH)4 |
|
Кислотная формула |
H2MeO2 |
HMeO2 |
H2MeO3 |
|
Пример |
H2BeO2 |
HCrO2 |
H2MnO3 |
Me – металл.
Классификация основных гидроксидов (оснований) по количеству гидроксо-групп.
|
Основания |
|
|
Однокислотные |
Двукислотные |
|
LiOH NaOH KOH |
Ca(OH)2 Fe(OH)2 Ba(OH)2 |
Однокислотные основания при диссоциации образуют лишь один гидроксид ион:
LiOH ↔ Li+ + OH‒
NaOH ↔ Na+ + OH‒
Двукислотные основания при диссоциации образуют два гидроксид-иона:
Ca(OH)2 ↔ Ca2+ + 2OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Основные гидроксиды не могут быть трёхкислотными или четырёхкислотными, так как в них металл будет иметь степень окисления «+3» или «+4», а это уже будет не основанием, а амфотерным гидроксидом.
Почему количество гидроксильных групп называется кислотностью? Потому что на нейтрализацию оснований требуется протон водорода из кислоты. Для нейтрализации однокислотных оснований потребуется один протон водорода, а на нейтрализацию двукислотного основания – два протона водорода и так далее. Например:
Молекулярное уравнение (МУ): NaOH + HCl = NaCl + H2O
Полное ионное уравнение (ПИУ): Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращение одинаковых ионов: Na+ + OH‒ + H+ + Cl‒ = Na+ + Cl‒ + H2O
Сокращенное ионное уравнение (СИУ): OH‒ + H+ = H2O
На нейтрализацию однокислотного основания потребовался один протон водорода из соляной кислоты.
Классификация оснований по силе
Основания также можно поделить на сильные и слабые. Сильные диссоциируют очень быстро, даже двухосновные распадаются на ионы на столько быстро, что можно не учитывать ступенчатость этого процесса:
LiOH ↔ Li+ + OH‒
Ba(OH)2 ↔ Ba2+ + 2OH‒
Слабые основания диссоциируют очень медленно, ступенчато:
Fe(OH)2 ↔ FeOH+ + OH‒ (первая ступень)
FeOH+ ↔ Fe2+ + OH‒ (вторая ступень)
Сильные основания растворимы или малорастворимы (исключение: гидроксид аммония будучи растворимым остаётся слабым основанием) и называются щелочами. Слабые основания нерастворимы.
Таб. «Сильные и слабые основания»
|
Основания |
|
|
Сильные (щелочи) |
Слабые |
|
Растворимы |
Нерастворимы (искл. NH4OH) |
|
Гидроксиды металлов IA-подгруппы, а также кальция, стронция и бария |
Все остальные |
|
Примеры: LiOH, NaOH, KOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Примеры: Mg(OH)2, Fe(OH)2, CuOH, Cr(OH)2, Mn(OH)2, Cu(OH)2 |


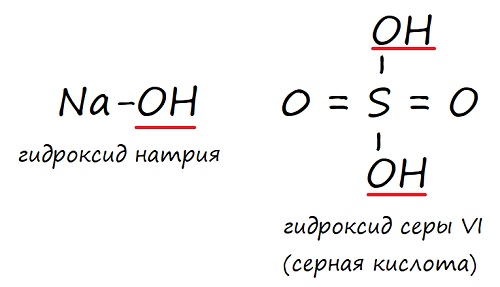
 Ca(OH)2
Ca(OH)2