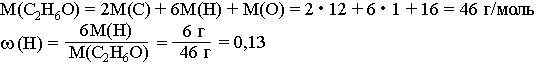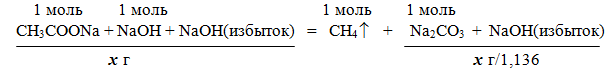Статьи
Линия УМК О. С. Габриеляна. Химия (8-9)
Химия
Массовая доля вещества
Ребятам, впервые пришедшим на урок химии, кажется: «Ух, какой отличный предмет. Столько разноцветных баночек и скляночек в лабораторном ящике. Вот сейчас я как нахимичу, друзья ахнут и выпадут в осадок».
Однако, при виде ровных рядков непонятных формул на доске энтузиазм у ребят испаряется быстрее, чем происходит взгонка кристаллов йода. Если подходить к химии, как к науке, которой нет места в реальной жизни, и просто заучивать ряды формул, то интерес может умереть очень быстро.
10 января 2019
Но все становится намного веселее, если поискать примеры химических реакций вокруг нас.
Костер в летнем походе, сквашивание овощей, изменение вкуса любимых блюд с помощью соли или сахара — это все химия.
Сегодня мы разберем одну из базовых тем «Массовая доля вещества в растворе».
Если хорошо изучить тему и научиться быстро решать задачи, можно не только определить, сколько ложек сахара бабушка добавила в свой чай, но и находить ответы на сложные криминалистические задачи.
Но перед тем, как приступить к практической части, стоит разобраться с теорией.
ОСНОВНЫЕ ТЕРМИНЫ
Основными терминами в этой теме будут:
-
Раствор — однородная смесь различных веществ в жидком виде.
-
Компоненты — вещества, которые подлежат смешиванию для получения раствора.
-
Растворитель — жидкий компонент, к которому добавляют субстанции для получения раствора.
-
Растворенное вещество — твердые или жидкие вещества, которые добавляют к растворителю для получения раствора.
-
Массовая доля — отношение массы вещества к массе раствора, в котором оно содержится.
-
Концентрация — отношение количества растворенного вещества к растворителю, выраженное в процентах.
Когда мы смешиваем между собой жидкости, которые идеально растворяются друг в друге, например воду и спирт, то можем любой из этих компонентов считать растворителем. Однако традиционно в водных растворах вода является растворителем, а второй ингредиент — растворенным веществом.
НЕОБХОДИМЫЕ ФОРМУЛЫ
Массовая доля вещества обозначается буквой греческого алфавита ω — омега. Чтобы ее определить, используется формула для вычисления массовой доли вещества.
ω (в-ва)= m (в-ва)/ m (р-ра) (1)
В этом равенстве массовая доля принимает значение от 0 до 1.
Однако в задачах чаще используется процентное соотношение, которое получается по следующей формуле:
ω (в-ва)= m (в-ва)/ m (р-ра)*100% (2)
Масса раствора равна сумме его компонентов.
m (р-ра)=m (в-ва)+m (р-ля) (3)
В случае двухкомпонентного раствора массовая доля растворенного вещества и массовая доля растворителя в сумме дают 100%
ω (в-ва)+ω (р-ля)=100% (4)
Масса раствора находится сложением масс компонентов, входящих в раствор
m (р-ра)=m (в-ва)+m (р-ля)(5)
Для успешного решения задачи на определение массовой доли вещества в растворе следует вспомнить еще одну формулу, которая связывает массу вещества, его объем и плотность.
m (в-ва)=p(в-ва)*V(в-ва) (6)
Напомним, что плотность воды составляет 1 г/мл. Это значит, что 100 мл воды весит ровно 100 гр.
Если возникает недопонимание теоретической части, более подробно теория изложена в учебнике «Химия. 8 класс» под редакцией О. С. Габриеляна, который можно найти на портале электронных учебников LECTA
#ADVERTISING_INSERT#
1. Массовую долю элемента в веществе рассчитывают по формуле:
.
2. Если имеется (1) моль вещества, то его масса равна
.
3. (1) моль вещества содержит (x) моль элемента. Поэтому масса элемента, содержащегося в веществе, равна
m(эл.)=n(эл.)⋅M(эл.)=xмоль⋅Mг/моль
.
4. Подставив массу элемента и массу вещества в формулу ((1)), получим формулу ((2)), которой и воспользуемся для вычисления:
w(эл.)=xмоль(эл.)⋅Mг/моль(эл.)1моль⋅M г/моль(вещества)⋅100
.
Пример:
таким образом, например, расчёт массовой доли углерода в оксиде углерода((IV)) должен выглядеть так:
1. по формуле вещества видно, что (1) моль
CO2
содержит (1) моль химического элемента (C).
2. Если имеется (1) моль
CO2
, то его масса равна
.
3. А (1) моль элемента (C) имеет массу
.
4. Таким образом, массовая доля элемента (C) в
CO2
равна
27,3
%
.
Что такое массовая доля в химии? Знаете ли вы ответ? Как находить массовую долю элемента в веществе? Сам процесс вычисления вовсе не так сложен. А вы еще испытываете затруднения в подобных задачах? Тогда вам улыбнулась удача, вы нашли эту статью! Интересно? Тогда скорее читайте, сейчас вы все поймете.
Что такое массовая доля?
Итак, для начала выясним, что такое массовая доля. Как находить массовую долю элемента в веществе, ответит любой химик, так как они часто употребляют этот термин при решении задач или во время пребывания в лаборатории. Конечно, ведь ее расчет — их повседневная задача. Чтобы получить определенное количество того или иного вещества в лабораторных условиях, где очень важен точный расчет и все возможные варианты исхода реакций, необходимо знать всего пару простых формул и понимать суть массовой доли. Поэтому эта тема так важна.
Этот термин обозначается символом “w” и читается как “омега”. Он выражает отношение массы данного вещества к общей массе смеси, раствора или молекулы, выражается дробью или в процентах. Формула расчета массовой доли:
w = m вещества / m смеси.
Преобразуем формулу.
Мы знаем, что m=n*M, где m — масса; n — количество вещества, выраженное в единицах измерения моль; M — молярная масса вещества, выраженная в грамм/моль. Молярная масса численно равна молекулярной. Только молекулярная масса измеряется в атомных единицах масс или а. е. м. Такая единица измерения равна одной двенадцатой доле массы ядра углерода 12. Значение молекулярной массы можно найти в таблице Менделеева.
Количество вещества n нужного объекта в данной смеси, равно индексу, умноженному на коэффициент при данном соединении, что очень логично. Например, чтобы рассчитать количество атомов в молекуле, надо узнать, сколько атомов нужного вещества находится в 1 молекуле = индекс, и умножить это число на количество молекул = коэффициент.
Не стоит бояться таких громоздких определений или формул, в них прослеживается определенная логика, поняв которую, можно даже сами формулы не учить. Молярная масса M равна сумме атомных масс Ar данного вещества. Напомним, что атомная масса — масса 1 атома вещества. То есть исходная формула массовой доли:
w = ( n вещества*M вещества)/m смеси.
Из этого можно сделать вывод, что если смесь состоит из одного вещества, массовую долю которого надо вычислить, то w=1, так как масса смеси и масса вещества совпадают. Хотя смесь априори не может состоять из одного вещества.
Так, с теорией разобрались, но как находить массовую долю элемента в веществе на практике? Сейчас все покажем и расскажем.
Проверка усвоенного материала. Задача легкого уровня
Сейчас мы разберем две задачи: легкого и среднего уровня. Читайте далее!
Необходимо узнать массовую долю железа в молекуле железного купороса FeSO4*7 H2O. Как решить эту задачу? Рассмотрим решение далее.
Решение:
Возьмем 1 моль FeSO4*7 H2O, тогда узнаем количество железа, умножив коэффициент железа на его индекс: 1*1=1. Дан 1 моль железа. Узнаем его массу в веществе: из значения в таблице Менделеева видно, что атомная масса железа 56 а. е. м. = 56 грамм/моль. В данном случае Ar=M. Следовательно, что m железа = n*M = 1 моль* 56 грамм/моль = 56 г.
Теперь нужно найти массу всей молекулы. Она равна сумме масс исходных веществ, то есть 7 моль воды и 1 моль сульфата железа.
m= (n воды* M воды) + (n сульфата железа*M сульфата железа) = (7 моль*(1*2+16) грамм/моль) + (1 моль* (1 моль*56 грамм/моль+1 моль*32 грамм/моль + 4 моль*16 грамм/моль) = 126+152=278 г.
Остается лишь разделить массу железа на массу соединения:
w=56г/278 г=0.20143885~0.2=20%.
Ответ: 20%.
Задача среднего уровня
Решим более сложную задачу. В 500 г воды растворено 34 г нитрата кальция. Нужно найти массовую долю кислорода в полученном растворе.
Решение
Так как при взаимодействии Ca(NO3)2 с водой идет только процесс растворения, а из раствора не выделяются продукты реакции, масса смеси равна сумме масс нитрата кальция и воды.
Нам нужно найти массовую долю кислорода в растворе. Обратим внимание на то, что кислород содержится как в растворенном веществе, так и в растворителе. Найдем количество искомого элемента в воде. Для этого посчитаем моль воды по формуле n=m/M.
n воды=500 г/(1*2+16) грамм/моль=27.7777≈28 моль
Из формулы воды H2O найдем, что количество кислорода = количеству воды, то есть 28 моль.
Теперь найдем количество кислорода в растворенном Ca(NO3)2. Для этого узнаем количество самого вещества:
n Ca(NO3)2=34 г/(40*1+2*(14+16*3)) грамм/моль≈0.2 моль.
n Ca(NO3)2 относится к n O как 1 к 6, что следует из формулы соединения. Значит, n O = 0.2 моль*6 = 1.2 моль. Суммарно количество кислорода равно 1.2 моль+28 моль=29.2 моль
m O= 29.2 моль*16 грамм/моль=467.2 г.
m раствора=m воды + m Ca(NO3)2= 500 г+34 г=534 г.
Осталось только само вычисление массовой доли химического элемента в веществе:
w O=467.2 г /534 г≈0.87=87%.
Ответ: 87%.
Надеемся, что мы понятно объяснили вам то, как находить массовую долю элемента в веществе. Данная тема вовсе не сложная, если в ней хорошо разобраться. Желаем вам удачи и успехов в будущих начинаниях.
ПОДГОТОВКА К ЭКЗАМЕНУ
«Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей»
Алгоритмы решения задач:
Пример 1. Вычисление массовой доли растворенного вещества
Определите массовую долю нитрата калия в растворе, полученном растворением 50 г нитрата калия в 200 г воды.
|
Дано: m(KNO3 ) = 50 г, m(Н2О) = 200 г. |
Решение ω(в-ва) = m(в-ва) / m(р-ра)*100 (%). m(р-ра) = m(в-ва) + m(Н2 О) = = 50 (г) + 200 (г) = 250 г. ω(KNO3 ) = = 50 (г) / 250 (г) * 100 (%) = 20 %. Ответ. ω(KNO3) = 20 %. |
|
ω(KNO3 ) – ? |
Пример 2. Вычисление массы растворенного вещества
Вычислите массу гидроксида калия в растворе объемом 600 мл и плотностью 1,082 г/мл, если массовая доля гидроксида калия составляет 10 %.
|
Дано: V(р-ра) = 600 мл, ρ = 1,082 г/мл, ω(KОН) = 10 %, или 0,1. |
Решение m(в-ва) = ω(в-ва)*m(р-ра). m(р-ра) = ρ*V(р-ра) = = 1,082 (г/мл)*600 (мл) = 649,2 г. m(KОН) = 649,2 (г)*0,1 = 64,92 г. Ответ. m(KОН) = 64,92 г. |
|
m(KОН) – ? |
Пример 3. Смешивание растворов с разными концентрациями одного вещества Смешали 300 г раствора с массовой долей хлорида натрия 20 % и 500 г раствора того же вещества с массовой долей 40 %. Вычислите массовую долю хлорида натрия в полученном растворе.
|
Дано: m1 = 300 г, ω1 = 20 %, или 0,2, m2 = 500 г, ω2 = 40 %, или 0,4. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 , где m1 , m2 , m3 – массы растворов. 300 (г)*0,2 + 500 (г)*0,4 = = 800 (г)*ω3 , 60 (г) + 200 (г) = 800 (г)*ω3 , 260 (г) = 800 (г)*ω3 , ω3 = 260 (г) / 800 (г) = 0,325, или 32,5 %. Ответ. ω3 (NaCl) = 32,5 %. |
|
ω3 – ? |
Пример 4. Разбавление водой
ω2 = 0, т.к. в воде не содержится вещество, находящееся в первом растворе.
Какую массу воды надо добавить к раствору гидроксида натрия массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 2 %?
|
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 0, ω3 = 2 %, или 0,02. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *0 = = (150 (г) + m2 )*0,02, 15 (г) + 0 = 3 (г) + 0,02m2 , 0,02m2 = 12 г, m2 = 12 (г) / 0,02 = 600 г. Ответ. m(Н2О) = 600 г. |
|
m2 – ? |
Пример 5. Концентрирование (добавление твердого вещества)
ω2 = 100 %, или 1, т.к. добавляемое вещество чистое.
Какую массу хлорида бария надо добавить к раствору хлорида бария массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 25 %?
|
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 100 %, или 1, ω3 = 25 %, или 0,25. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *1 = = (150 (г) + m2 )*0,25, 15 (г) + 1*m2 = 37,5 (г) + 0,25m2 , 0,75m2 = 22,5 г, m2 = 22,5 (г) / 0,75 = 30 г. Ответ. m(BaCl2 ) = 30 г. |
|
m2 – ? |
Пример 6. Упаривание раствора (частичное выпаривание воды)
Вычислите массовую долю хлорида натрия в растворе, если из 200 г 30 %-го раствора испарилось 50 г воды.
|
Дано: m1 = 200 г, ω1 = 30 %, или 0,3, m2 = 50 г, ω2 = 0. |
Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 200 (г)*0,3 + 50 (г)*0 = = 150 (г)*ω3 , 60 (г) = 150 (г)*ω3 , ω3 = 60 (г) / 150 (г) = 0,4, или 40 %. Ответ. ω3 (NaCl) = 40 % |
|
ω3 – ? |
ПРИМЕРЫ ЗАДАЧ
1. Какая масса карбоната натрия (в граммах) потребуется для приготовления 0,5 л 13%-го раствора плотностью 1,13 г/мл?
а) 73,45; б) 50; в) 72; г) 75.
2. Из раствора хлорида бария массой 100 г с массовой долей соли 3 % выпарили 25 г воды и до- бавили в него 15 г соли. Массовая доля соли (в %) в полученном растворе равна:
а) 12; б) 15; в) 18; г) 20.
3. Смешали 120 г раствора серной кислоты с массовой до лей 20 % и 40 г 50%-го раствора того же вещества. Определите массовую долю кислоты (в %) в полученном растворе.
а) 25; б) 27,5; в) 27; г) 29,5.
4. Какая масса азотной кислоты (в граммах) содержится в 1 л ее 20%-го раствора с плотностью 1,05 г/мл?
а) 105; б) 63; в) 210; г) 176.
5. Какая масса соли (в граммах) вводится в организм человека при вливании 353 г 0,85%-го физиологического раствора?
а) 3; б) 6; в) 4; г) 2 г.
6. К 180 г 8%-го раствора хлорида натрия добавили 20 г NaCl. Найдите массовую долю (в %) хлорида натрия в образовавшемся растворе.
а) 17,2; б) 17,4; в) 18; г) 12,7.
7. К раствору хлорида кальция массой 140 г с массовой долей соли 5 % добавили 10 г этой же соли. Определите массовую долю (в %) хлорида кальция в полученном растворе.
а) 13,1; б) 14; в) 11,3; г) 25.
8. Какую массу соли (в граммах) надо добавить к 60 г раствора с массовой долей этой соли 10 %, чтобы получить раствор с массовой долей 40 %?
а) 15; б) 22; в) 17; г) 30.
9. Смешали 200 г 15%-го раствора нитрата хрома(III) и 300 г 20%-го раствора той же соли. Вычислите массовую долю (в %) ни- трата хрома(III) в полученном растворе.
а) 24; б) 18; в) 17,9; г) 18,1.
10. Из 150 г раствора хлорида натрия с массовой долей 5 % выпарили 10 г воды и добавили 5 г той же соли. Вычислите массовую долю (в %) соли в полученном растворе.
а) 8,4; б) 8,6; в) 9; г) 11,2.
11. Смешали 200 г 5%-го и 400 г 12,5%-го растворов серной кислоты. Найдите массу кислоты в полученном растворе (в граммах).
а) 60; б) 98; в) 49; г) 58.
12. При растворении 16 г гидроксида натрия получили 10%- й раствор. Определите массу (в граммах) взятой для этого воды.
а) 126; б) 144; в) 151; г) 164.
13. К 200 г 10%-го раствора ни- трата калия добавили некоторую порцию нитрата калия и получи- ли 20%-й раствор. Найдите массу (в граммах) добавленной порции твердого вещества. а) 2,5; б) 5; в) 25; г) 15.
14. Найдите массу воды (в граммах), которую нужно добавить к 300 г 8%-го раствора сульфата натрия для получения 5%-го раствора.
а) 90; б) 45; в) 18; г) 180.
15. Какая масса раствора (в граммах) получится при упаривании 200 г 5%-го раствора гидроксида калия до 20%-го раствора?
а) 10; б) 45; в) 100; г) 50.
16. 92 мл 10%-го раствора серной кислоты (плотность 1,066 г/мл) полностью нейтрализовали 40%-м раствором гидроксида натрия. Найдите массу затраченного на нейтрализацию раствора гидроксида натрия (в граммах).
а) 10; б) 55; в) 20; г) 30.
17. Определите, какую массу гидроксида калия (в граммах) нужно добавить к 150 г 20%-го раствора гидроксида калия для получения 40%-го раствора.
а) 5; б) 50; в) 56; г) 78.
18. К 200 г 8%-го раствора хлорида натрия добавили 50 г воды. Вычислите массовую долю (в %) соли в образовавшемся растворе.
а) 6,4; б) 6,5; в) 6,1; г) 6,2.
19. Определите массу воды (в граммах), которую надо добавить к 20 г 70%-го раствора уксусной кислоты для получения 5%-го раствора уксуса.
а) 260; б) 130; в) 26; г) 258.
20. Определите массу сахара (в граммах), необходимую для приготовления 0,5 кг 45%-го раствора.
а) 245; б) 225; в) 345; г) 500.
21. Вычислите массовую долю соляной кислоты (в %) в растворе, полученном при растворении 11,2 л (н.у.) хлороводорода в 1 л воды.
а) 1,3; б) 1,6; в) 1,8; г) 3,6.
22. Вычислите массу 40%-го раствора уксусной кислоты (в граммах), которую необходимо добавить к 500 г воды для получения 15%-го раствора.
а) 29; б) 32; в) 48; г) 300.
23. Массовая доля соли в морской воде составляет 3,5 %. Найдите массу соли (в граммах), которая останется после выпаривания 5 кг морской воды.
а) 175; б) 170; в) 167; г) 163.
24. Смешали 250 г раствора гидроксида натрия с массовой долей 16 % и 300 мл раствора (ρ = 1,2 г/мл) с массовой долей того же вещества 20 %. Рассчитайте массу гидроксида натрия (в граммах) в полученном растворе:
а) 120; б) 112; в) 11; г) 115.
25. Какова масса поваренной соли (в граммах), которую следует растворить в 250 г раствора этой соли с массовой долей 10 % для получения раствора с массовой долей 18 %?
а) 22; б) 42,4; в) 24,4; г) 44.
26. К 50 г раствора хлорида кальция с массовой долей 3,5 % добавили 5 г этой же соли и 20 г воды. Определите массовую долю (в %) соли в полученном растворе.
а) 6; б) 7; в) 8; г) 9.
27. Какая масса серной кисло ты (в граммах) содержится в 0,6 л ее 40%-го раствора с плотностью 1,3 г/мл?
а) 63; б) 26; в) 60; г) 312.
28. Найдите массу хлорида натрия (в граммах), который необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %.
а) 20; б) 12,5; в) 5; г) 24.
29. К 350 г водного раствора этанола с массовой долей 20 % добавили 120 мл спирта (плотность 0,8 г/мл). Рассчитайте массу спирта (в граммах) в полученном растворе.
а) 167; б) 156; в) 166; г) 170.
30. Из 50 г раствора хлорида натрия с массовой долей 2 % выпарили 10 г воды и добавили 5 г этой же соли. Определите массовую долю соли (в %) в полученном растворе.
а) 6,3; б) 13,3; в) 8,9; г) 9,4
Ответы. 1–а, 2–г, 3–б, 4–в, 5–а, 6–а, 7–в, 8–г, 9–б, 10–б, 11–а, 12–б, 13–в, 14–г, 15–г, 16–в, 17–б, 18–а, 19–а, 20–б, 21–в, 22–г, 23–а, 24–б, 25–в, 26–г, 27–г, 28–б, 29–в, 30–б.
Определение массовой доли (ω) вещества
Многие характеристики вещества являются суммой нескольких составляющих, каждая из которых представляет определенную долю от целого.
Математически долю каждой составляющей определяют как частное от деления части на целое (меньшей величины на большую).
Важными характеристиками состава многокомпонентных систем (молекул, смесей веществ, растворов, сополимеровСополимеры – высокомолекулярные соединения, макромолекулы которых содержат два (и более) типа структурных звеньев.) являются массовые, мольные и объёмные доли отдельных компонентов.
Массовая доля компонента (вещества, химического элемента) – содержание компонента в многокомпонентной системе (смеси веществ, растворе, молекуле), определяемое как отношение массы этого компонента к суммарной массе всех компонентов системы.
Таким образом, для нахождения массовой доли вещества в смеси (и решения обратной задачи) служит соотношение:
ω(вещества) = m(вещества) / m(смеси).
Массовую долю элемента в веществе можно определить, используя молярные массы:
ω(элемента) = M(элемента) / M(вещества).
Например, массовая доля водорода ω(H) в этиловом спирте С2Н5ОН вычисляется следующим образом:
Часто долю выражают в процентах. Для этого полученный результат умножают на 100. То есть в данном случае ω(H)=13%. Это означает, что в каждом г (кг, т) С2Н6O содержится 0,13 г (кг, т) водорода или каждые 100 г (кг, т) С2Н6O содержат 13 г (кг, т) водорода.
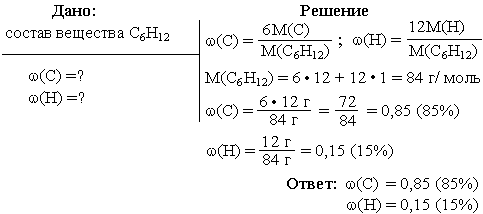
Задача 1. Вычислить массовые доли каждого из элементов, входящих в состав углеводорода, формула которого C6H12.
Задача 2. Из нефти получают бензин (массовая доля его в нефти составляет 25%) и мазут (55%). При дальнейшей переработке мазута получают еще некоторое количество бензина (60% от массы мазута). Рассчитайте массу бензина, который будет получен из нефти массой 200 кг.
Задача 3. Смесь ацетата натрия с избытком гидроксида натрия прокалили. После прокаливания масса сухого остатка оказалась в 1,136 раза меньше массы исходной смеси. Вычислите массовые доли компонентов исходной смеси.
Решение
При сплавлении ацетата натрия CH3COONa с гидроксидом натрия образуется метан CH4 (реакция Дюма).
Уравнение реакции: