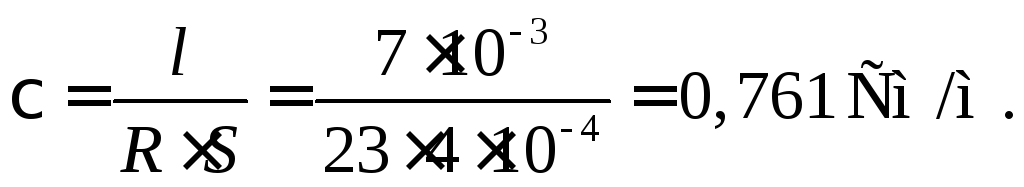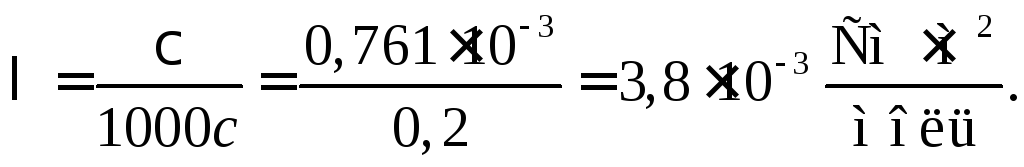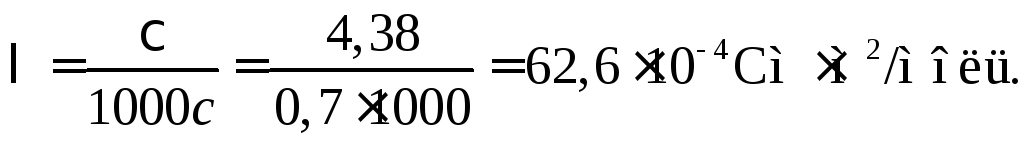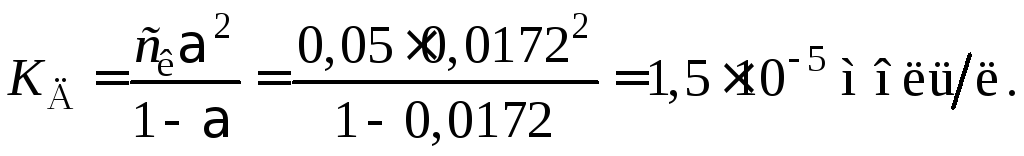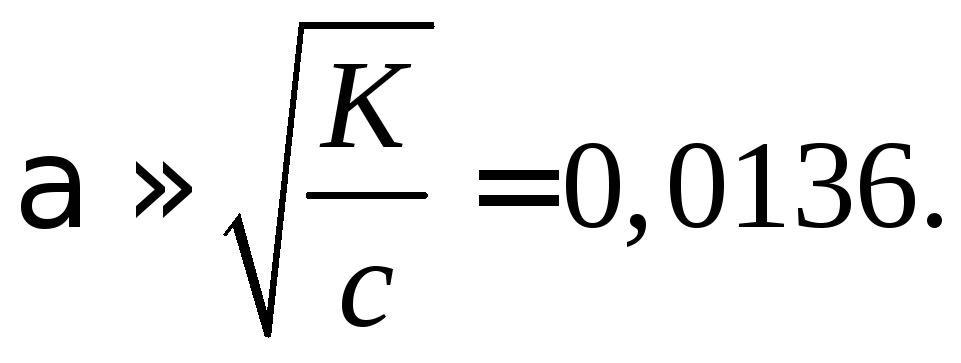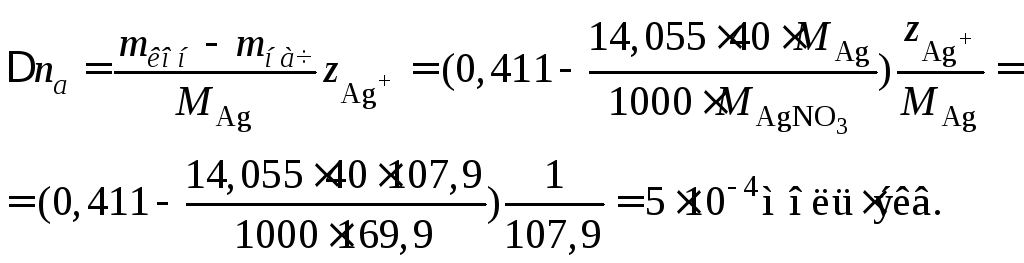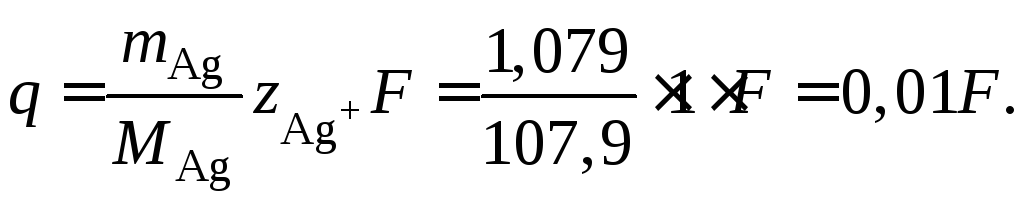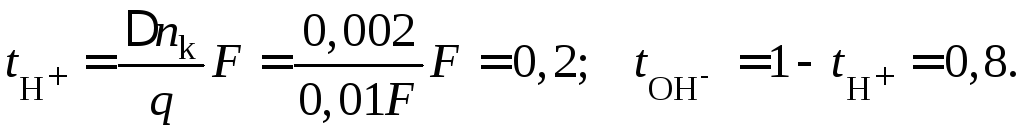Пример
34.
Сосуд для измерения электропроводности
заполнен 0,1 М раствором CuSO4.
Площадь каждого электрода 4 см2.
Расстояние между ними 0,7 см. Сопротивление
слоя раствора между электродами равно
23 Ом. Определить удельную и эквивалентную
электропроводность раствора.
Решение
Подставляя в
выражение
= 1/
величину
из уравнения
,
получаем:
Для
расчета эквивалентной электропроводности
находим молярную концентрацию эквивалентов
раствора CuSO4.
Эквивалентное число соли CuSO4
=12=
2. Поэтому число молей эквивалентов
вдвое больше числа молей CuSO4
и соответственно молярная концентрация
эквивалентов вдвое больше молярной:
сэк
= с
= 20,1
= 0,2 моль (экв)/л. Тогда
Пример
35. Вычислить
предельную эквивалентную электропроводностьраствора гидроксида аммония NH4OH
при 25С, если значениядля BaCl2, Ba(OH)2и NH4Cl равны
соответственно 120,310–4,
228,810–4и
129,810–4.
Решение
Cогласно закону Кольрауша:
Алгебраически суммируя данные выражения,
получаем:
Пример 36.
Удельная электропроводность 5%-ного (по
массе) водного раствора Mg(NO3)2
составляет 4,38 См/м. Плотность раствора
1,0378 г/см3.
Каковы эквивалентная электропроводность
раствора и кажущаяся степень диссоциации
Mg(NO3)2,
если при бесконечном разведении
эквивалентная электропроводность
раствора равна 109,810–4
Смм2/моль?
Решение
Масса 1 л раствора
mp
= 1,03781000
= 1037,8 г. В нем находится m2=1037,85/100
= 51,89 г соли Mg(NO3)2,
молярная масса эквивалентов которой
равна М2экв.
= 148,3/2 =74,15 г/моль (экв). Тогда молярная
концентрация эквивалентов (нормальность)
с= 51,89/74,15 = 0,7 моль (экв)/л = 0,7 н.
Эквивалентная
электропроводность раствора
Кажущаяся
степень диссоциации
Пример 37.
Удельная электропроводность 0,05 н водного
раствора уксусной кислоты равна 0,0324, а
0,0001 н раствора CH3COONa
–7,7510–4
См/м. Определить константу и степень
диссоциации уксусной кислоты в 0,05 н
растворе. Предельные электропроводности
ионов Na+
и Н+
соответственно равны 50,510–4
и 35010–4
Смм2/моль.
Соль считать полностью диссоциированной.
Решение
Вычисляем эквивалентные
электропроводности растворов кислоты
и соли:
Так
как соль полностью диссоциирована, то
есть
= 1, то
.
По
закону Кольрауша
.
Отсюда
.
Смм2/моль.
Тогда
степень диссоциации кислоты
.
Константа
диссоциации кислоты

или
Пример
38. Вычислить
эквивалентную и удельную электропроводность
0,1 н раствора уксусной кислоты при
25 С,
исходя из следующих справочных данных:
константа диссоциации СН3СООН
К
= 1,8510–5
моль/л;
и
Смм2/моль.
Решение
Вычисляем степень
диссоциации СН3СООН,
учитывая, что
с/К
= 0,1/1,8510–5
> 100, по формуле
Определяем
предельную эквивалентную электропроводность
Находим
эквивалентную электропроводность
заданного раствора
=
= 0,0136390,710–4
= 5,3110–4
.
Рассчитываем
удельную электропроводность
= 1000с
= 0,11035,3110–4
= 0,0531 См/м.
Пример
39. Удельная
электропроводность насыщенного водного
раствора хлорида таллияTlClпри 25С равна 2,410–4См/м. Эквивалентная электропроводность
раствора этой соли при бесконечном
разведении равна 1,5110–2Смм2/моль.
Вычислить растворимостьTlClпри 25С
и произведение растворимостиTlCl.
Решение
Для насыщенного раствора справедливо
равновесие
TlClнас
= Tl+
+ Cl
равн. концентрация,
моль/л с с
Растворимость
соли S=с
может быть найдена из выражения
,
представленного
в виде
Произведение
растворимости соли
L=
[Tl+][Cl]
= (с)2
= (1,5910–5)2
= 2,5310–10 (моль/л)2.
Пример 40.При электролизе между
серебряными электродами раствора,
содержавшего 14,055 гAgNO3в 1000 гH2O,
выделилось 0,102 г серебра. После электролиза
анодное пространство содержало 0,411 г
серебра в 40 г воды. Определить числа
переносаAg+иNO3–.
Решение
При электролизе между серебряными
электродами идут реакции растворения
анода и осаждения металла на катоде.
Составим материальный баланс по серебру
для анодного пространства: от растворения
анода в раствор переходит количество
серебра (моль)
уходит серебра с током из анодного слоя
к катодуУвеличение
количества серебра в анодном пространстве
составляет

Это увеличение определим по изменению
массы серебра в анодном пространстве
в расчете на 40 г воды
Полагая, что
количество растворившегося на аноде
серебра равно количеству осадившегося
серебра на катоде, получаем для чисел
переноса аниона и катиона
Пример 41.Водный растворNaOHс
концентрацией 1 моль/л подвергнут
электролизу между платиновыми электродами.
После электролиза титрованием установлено,
что концентрацияNaOHв
катодном слое равна 1,04 н. Объем катодного
слоя 50 мл. За время электролиза в
последовательно присоединенном
серебряном кулонометре выделилось
1,079 г серебра. Найти числа переноса ионов
Н+и ОН–.
Решение
При электролизе NaOHмежду
инертными платиновыми электродами на
аноде идет разрядка ионов ОН–
а на катоде – восстановление ионов
Количество разрядившихся ионов Н+и ОН–(моль экв) пропорционально
количеству прошедшего электричества,
которое можно найти по массе выделенного
в кулонометре серебра
Составим материальный баланс по
количеству ионов ОН–для катодного
пространства, который определяется
увеличением количества ионов ОН–за счет разряда ионов Н+воды на
катоде, пропорциональнымq;
уменьшением количества ионов ОН–за счет ухода ОН–к катоду,
пропорциональным.
Суммарное изменение количества ионов
ОН–в катодном пространстве
и может быть найдено по изменению
концентраций раствора NaOHв катодном слое объемомV=50
мл (0,05 л)
Тогда
Пример 42.Через
0,1 н водный растворAgNO3пропущен ток между платиновыми
электродами. После прохождения 0,001Fэлектричества титр раствора в анодном
слое уменьшился на 0,0675 г/мл (в расчете
наAgCl) по сравнению с
титром до электролиза. Найти число
переносав этом растворе.
Решение
При электролизе AgNO3между нерастворимыми платиновыми
электродами на катоде восстанавливается
серебро,
а на аноде идет разрядка ионовOH–воды
Уменьшение концентрации AgNO3в анодном слое связано только с уходом
к катоду ионов серебра, поэтому
,
Поэтому
Пример 43.Число
переноса иона водорода в 0,05 н растворе
НCl(=1)
определяли методом движущейся границы.
Под действием тока силой 0,003 А граница
«прошла» объем раствора, равный 0,159 мл
за 311 с. Найти число переноса ионов Н+.
Решение
Из уравнения (7.7) вычисляем число переноса
ионов Н+:
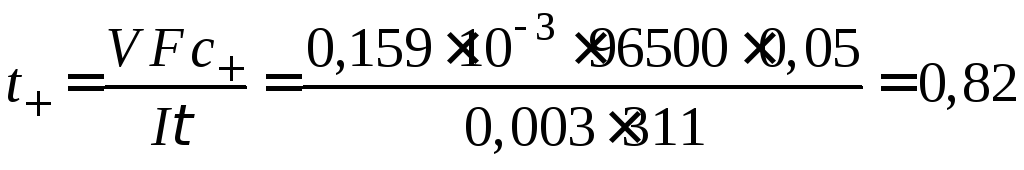
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Метод может быть реализован в варианте прямой кондукто-метрии или кондуктометрического титрования. Прямую кондук-тометрию используют для определения концентрации растворов сравнительно редко, поскольку регистрируемый аналитический сигнал не избирателен электропроводность раствора — величина аддитивная, определяемая наличием всех ионов в растворе. Прямые кондуктометрические измерения успешно используют, например, для оценки чистоты растворителя, определения общего солевого состава морских, речных и минеральных вод, а также для определения таких важных для аналитической химии величин, как константы диссоциации электролитов, состав и константы устойчивости комплексных соединений, растворимости малорастворимых электролитов. [c.104]
Увеличение концентрации электролита приводит к увеличению числа ионов в растворе, и сначала удельная электропроводность растет. Однако вместе с ростом числа ионов уменьшается скорость их перемещения, а также степень диссоциации. Первый фактор действует в растворах сильных электролитов, а второй — в растворах слабых электролитов. При достижении определенной концентрации раствора влияние перечисленных факторов становится настолько большим, что дальнейшее увеличение концентрации приводит к уменьшению электропроводности (рис. 74). [c.222]
Кондуктометрическое титрование относится к физико-химическим методам анализа. Измерение электропроводности часто производят для определения содержания солей (например, в котельной воде, при сгущении молока и в ряде других случаев). На некоторых производствах установки по измерению электропроводности в сочетании с автоматическими устройствами позволяют поддерживать определенную концентрацию растворов, применяемых в тех или иных производственных процессах. [c.277]
Следует отметить, что определение концентрации растворов по их электропроводности осуществимо не для всех реагентов. Наглядным примером является известковое молоко (рис. 39). Удельная электропроводность заметно возрастает только для концентрации 2 л, т. е. в пределах растворимости извести, при дальнейшем возрастании концентрации реагента (уже в виде суспензии) электропроводность в начале практически не изменяется, а затем начинает падать. Последнее происходит в результате экранирования поля электрического тока нерастворимыми взвешенными веществами. Поэтому в суспензиях концентрационный коэффициент изменения электропроводности, как правило, [c.103]
Определение концентрации растворов хлористого натрия, хлористого кальция, сернокислого натрия по электропроводности. [c.193]
Построить калибровочную кривую для определения концентрации по электропроводности. Выяснить наиболее удобный вид этой кривой. Определить концентрацию раствора, если электропроводность раствора 0,0500, 0,0045, 0,1230 ож-1. [c.376]
Кондуктометры и солемеры (табл. 21) служат для измерения электропроводности растворов, определения концентрации растворов электролитов, контроля чистоты воды, кондуктометрического титрования, высокочастотного титрования. [c.277]
Определение концентрации растворов методом электропроводности сводится к измерению сопротивления электролита в сосуде с двумя электродами. Измерительные приборы питаются переменным током, чтобы избежать поляризации электродов и связанных с ней погрешностей измерений. [c.515]
Все рассмотренные методы и приборы для измерения концентрации по электропроводности, плотности и с помощью фотоколориметров не являются универсальными. Каждый из этих методов пригоден только для определенных растворов (например, электролитов, окрашенных или мутных жидкостей). В методы определения концентрации по электропроводности и плотности необходимо ввести температурную компенсацию. Эти же методы связаны с введением в анализируемый раствор измерительных электродов. Для того чтобы электроды были химически стабильны в различных агрессивных средах, их необходимо изготовлять из дорогостоящей платины. [c.519]
Определение концентрации раствора по его электропроводности [c.361]
На зависимости электропроводности раствора от содержания в нем растворенного вещества основано прямое кондуктометрическое определение концентрации растворов. [c.361]
Электропроводность водных растворов. Приготовление растворов одинаковой нормальности. Определение концентрации растворов методом титрования. Сравнение силы кислот и оснований. Изменение концентрации водородных и гидроксильных ионов. Изменение окраски индикаторов в кислых и щелочных растворах. Определение pH растворов. Произведение растворимости. [c.28]
Наиболее распространенный метод определения концентрации растворов путем измерения электропроводности связан с изучением влияния на электропроводность, кроме концентрации, также и других факторов, например температуры или содержания солей железа и трехвалентного хрома в электролитах хромирования. [c.107]
Определение концентрации растворов электролитов методом электропроводности состоит в измерении сопротивления (электропроводности) электролитической ячейки . Эта ячейка представляет собой сосуд, заполненный анализируемым раствором, в который опущены два электрода. [c.134]
Значительный интерес представляют получившие в последнее время распространение индукционные методы непрерывного определения концентрации растворов электролитов (в частности, растворов серной кислоты) по электропроводности. [c.147]
При малых концентрациях растворов число ионов в 1 см раствора мало и, так как ток переносится ионами, мала удельная электропроводность растворов. По мере роста концентрации растет и число ионов в 1 см раствора и соответственно растет удельная электропроводность. Однако при достижении определенных концентраций раствора удельная электропроводность начинает уменьшаться в случае сильных электролитов из-за усиления торможения ионов за счет релаксационного и электрофоретического эффектов, а в случае слабых электролитов — из-за уменьшения степени диссоциации. [c.25]
Большое практическое значение имеет кондуктометрическое титрование, т. е. определение концентрации электролита в растворе путем измерения электропроводности при титровании. Этот способ является особенно ценным в случае мутных или сильно окрашенных растворов, которые титровать с применением обычных индикаторов часто невозможно. [c.412]
Реакции в растворах также прослеживаются с помощью физических или физико-химических методов, например из измерений электропроводности (применяются для исследования кинетики ионных реакций, в результате меняется общее число ионов), из измерений поглощения света (в соответствии с законом Ламберта — Бера поглощение света пропорционально концентрации вещества). Различие в оптической активности исходных веществ и продуктов реакции также может быть использовано для определения концентрации (например, при исследовании инверсии сахарозы). Применение полярографических методов анализа основано на том, что предельный ток диффузии пропорционален концентрации. [c.167]
В растворах, где в качестве растворителей используются органические жидкости, электролитическая диссоциация при растворении в них веществ не наблюдается (опыты Д, Е и К). Степень электролитической диссоциации ледяной уксусной и концентрированной серной кислот очень мала и потому они слабо проводят электрический ток. Однако по мере разбавления этих кислот водой диссоциация их молекул на ионы сильно увеличивается, возрастают (опыты Ж, 3 и И) и их электропроводности. Однако при дальнейшем разбавлении, достигнув определенного максимального значения, электропроводность постепенно уменьшается. Объясняется это тем, что при разбавлении увеличение концентрации ионов в растворе происходит за счет увеличения степени электролитической диссоциации электролита. Последующее уменьшение величины электропроводности при дальнейшем разведении электролита объясняется общим уменьшением концентрации ионов в единице объема раствора. [c.63]
После проверки температурного режима термостата следует собрать схему для измерения электропроводности или, если работают с мостиком для измерения емкостей и сопротивлений, включить прибор в сеть. Затем приготовить раствор мочевины определенной концентрации. На аналитических весах отвесить навеску мочевины и поместить ее в мерную колбу емкостью 50 мл и довести объем раствора в колбе до метки дистиллированной водой, выдержанной в термостате. [c.371]
Для определения концентрации HF используют зависимость удельной электропроводности >с от содержания кислоты в растворе [c.171]
Измерение электропроводности можно использовать для определения концентрации электролита. Особенно удобно применять его в случае разбавленных растворов, а также когда электролит является микрокомпонентом в присутствии большого количества неэлектролитов, в частности в неводных средах. Определения можно проводить и в окрашенных, мутных и совсем непрозрачных растворах. [c.196]
Определение постоянной электролитической ячейки. В ка честве стандартного раствора для определения постоянной электролитической ячейки используют раствор хлорида калия разной концентрации, насыщенный раствор хлорида натрия или сульфата кальция, приготовленные на бидистилляте. Удельные электропроводности этих растворов при различных температурах определены с большой точностью и приведены в справочных таблицах. Постоянную ячейки типа Х38, предназначенную для определения малой удельной электропроводности растворов, рекомендуется устанавливать по Хст и Rx, -i 0,001 н. раствора КС1. Для ячеек других конструкций стандартный раствор указывается в соответствующей лабораторной работе. [c.102]
Удельная электропроводность растворов Б точке максимума прямо пропорциональна рабочей частоте со, т. е. характеристическая кривая g — к с увеличением частоты смещается вправо (рис. 21,6). Это дает возможность путем выбора рабочей частоты поля всегда работать на том склоне характеристической кривой, который отвечает условиям и задачам эксперимента. Вместе с тем появляется возможность предвидеть диапазон концентраций растворов, где расположен максимум характеристической кривой, и, таким образом, избежать резкого снижения чувствительности приборов к изменению свойств объекта в области максимума. Правильный выбор рабочей частоты позволяет при определениях избежать двузначности отсчетов по прибору. [c.120]
Кондуктомерия (от англ. ondu tivity — электропроводность и метрия)—электрохимический метод анализа, оспованный на измерении электропроводности растворов. К- применяется для определения концентрации растворов солей, кислот, оснований, для контроля состава некоторых промышленных растворов. Консистентные смазки (от лат. onsisto — застываю, густею)—смеси минеральных масел с загустителями (солями высших жирных кислот, парафино.м и др.). К К. с. относят антифрикционные для смазки зубчатых колес, цепей, подшипников предохранительные для покрытия металлических изделий. [c.70]
Например, для определения концентрации раствора хлорида натрия предварительно готовят раствор, содержащий 200 г/.г этого вещества. Затем, разбавляя раствор, приготовляют серию стандартных растворов, содержащих 40, 60, 80 и 100 г/л хлорида натрия. В электролитической ячейке, постоянная которой была определена раньше (см. формулу б), определяют удельную электропроводность этих растворов х равна соответственно 0,0510, 0,0730, 0,0940 и 0,1140 ом- -с.и-. Строят график, откладывая на оси абсцисс концентращш, а на оси ординат з дельную электропроводность. При помощи этого графика, или калибровочной кривой, можно определить содержание хлорида натрия в растворе, содержащем от 40 до 100 г/л. [c.361]
Для оценки ослабленной способности ионов к химическим реакциям, вызываемой их электростатическим взаимодействием, в настоящее время пользуются термином активная концентрация иона, под которой подразумевают ту концентрацию его, которая отвечает определенным свойствам раствора электропроводности, понижению температуры замерзания и повышению температуры кипения и др. Таким образом, активная концентрация 1юна (а о д) — это действующая (эффективная), но условная концентрация иона. Естественно было принять, что она пропорциональна концентрации иона (С ) [c.71]
Растворы, содержащие менее 0,05 моль1л хлорокиси, полностью диссоциированы и гидролизованы. Кислотность их, обусловленная образованием в растворе соляной кислоты, увеличивается с повы- шением концентрации (рис. 11). О кислотности растворов свидетельствует и значение электропроводности, которая увеличивается с повышением концентрации (рис. 12, 13) молекулярная электропроводность увеличивается по мере разбавлен я раствора спиртом. Характеристикой стабильности растворов и контрольными определениями концентрации растворов ггОСЬ-вНгО и НЮСи-ВНгО в сухом этиловом спирте могут служить измерения плотности и показателя преломления. Кислотность растворов [c.73]
Для нескольких водных растворов 1—1. электролитов, имеющих общий катион, известны значения эквивалентной электропроводности к при различных напряженностях электрического поля Р и определенной концентрации с. Температура растворов 25° С. Рассчитать число переноса к,1тиона /+ и величину эквивалентной электропроводности а 1иона при бесконечном разбавлении в каждом электролите. Установить характер влияния природы аниона на величину 4-. [c.51]
ИЗО.МОЛЯРНЫХ СЕРИЙ МЕТОД — метод исследования, по которому находят коэффициенты стехиометрическсго ураанения реакции между двумя или большим числом компонентов, определяют состав растворенного вещества, не выделяя его из раствора, доказывают, что реакция идет между компонентами в растворе. Условие И. с. м. заключается в том, что растворы реагирующих компонентов смешивают в различных соотношениях, так что общая сум-ыа концентраций компонентов остается постоянной концентрация всех остальных веществ, присутствующих в растворе, а также pH и другие условия должны быть постоянными. После измерения численных значений свойств каждого раствора серии (напр., оптической плотности в определенном участке спектра, электропроводности, экстрагируемо-сти и др.) изучают взаимосвязь между полученными данными и делают соответствующие заключения. [c.104]
Таким образом, при определении констант возникают ошибки, связанные с изменением электропроводности ионов и коэффициентов активности с концентрацией. Обе эти ошибки стремятся к нулю по мере уменьшения концентрации раствора. Если построить график IgAT —l//, то получится, [c.125]
Проводимость измеряет, насколько хорошо электрический ток проходит через раствор и напрямую связан с концентрацией ионов. Чем выше концентрация ионов в вашем растворе, тем лучше он проводит электричество. Используйте стандартный коэффициент пересчета, чтобы получить наилучшую оценку концентрации, если известна электропроводность.
-
Измерение проводимости
-
Преобразовать в Ом
-
Рассчитать Ppm
-
Изменить на молярность
-
Температура может влиять на проводимость. Для получения наилучших результатов измерьте свое решение в среде с температурой 25 градусов Цельсия или используйте измеритель проводимости, который корректирует свои показания в зависимости от температуры окружающей среды.
Если в вашем растворе содержится много растворенных веществ, вы не сможете рассчитать молярность по проводимости. Преобразование проводимости в концентрацию лучше всего работает в растворе только с одним растворенным веществом.
Измерьте проводимость вашего раствора. Различные измерители проводимости различаются по своей работе, но обычно вы помещаете датчик в раствор и ждете, пока показания не стабилизируются на дисплее. Ток обычно выражается в микроомах или микросименах (эти единицы равны друг другу), хотя некоторые старые измерители могут считывать только удельное сопротивление.
Преобразовать текущее чтение в Омы. Если ваш измеритель не преобразуется в микрооммы или микрооменты для вас, запишите показания удельного сопротивления и используйте закон Ома, чтобы найти проводимость. Для следующих формул G — проводимость в омах, R — удельное сопротивление, V — напряжение, а I — амперы:
R = I ÷ V
G = 1 ÷ R
Затем G делится на 1 миллион, чтобы получить микроом или микросимены.
Рассчитайте ppm (частей на миллион) из микроомов (мера проводимости). Умножьте микроом или микросимены на 0, 64, чтобы получить ppm. Таким образом, концентрация в миллионных долях = проводимость в микроомах x 0, 64.
Измените ppm на молярность. В большинстве случаев вы хотите знать молярность, а не ppm для вашего решения. Используйте следующие принципы для расчета молярности:
ppm = 0, 001 г растворенного вещества в 1 л раствора (растворенное вещество — это вещество, растворенное в растворителе для приготовления раствора).
Молярность = моль / литр, поэтому, взяв атомный вес (грамм / моль) растворенного вещества (находится либо в периодической таблице, либо на этикетке бутылки с растворенным веществом), вы можете рассчитать молярность.
м.д. (грамм / литр), деленная на атомный вес (грамм / моль), равна молярности (моль / литр).
подсказки
Задачи по химии, связанные с произведением растворимости солей
Вычисление произведения растворимости соли по удельной электропроводности раствора её
Задача 309.
При 25 °С удельная электропроводность раствора трудно растворимой соли (BaCO3) равна 0,00054 См . м-1. Удельная электропроводность дважды перегнанной дистиллированной воды при тех же условиях составляет 4,0 .10-6 См . м-1. Вычислите произведение растворимости указанной соли.
Решение:
χ(р-ра) = 0,000272 См . м-1;
χ(Н2О) = 4,0⋅10^-6 См . м-1;
ПР(ВаСО3) = ?
Удельная электропроводность водного раствора слагается из электропроводности соли и воды. Поэтому для растворов с малой электропроводностью необходимо учесть электропроводность воды.
Тогда
χ(ВаСО3) = χ(р-ра) — χ(Н2О) = 0,00054 — 4,0⋅10^-6 = 0,000536 См . м-1.
Концентрация насыщенных растворов малорастворимых солей, к которым относятся и ВаСО3 очень незначительна, поэтому такой раствор можно рассматривать как бесконечно разбавленный:
λ = λ∞ = λ∞(+) + λ∞(+), где
λ — мольная электропроводность раствора вещества, Ом-1 . м2 . моль-1;
λ∞ — подвижная эквивалентная электропроводность раствора вещества.
λ∞ — подвижная эквивалентная электропроводность при бесконечном разведении вещества, т.е. когда степень диссоциации электролита равна 1,
λ∞(+) и λ∞(+) — подвижность (предельная эквивалентная электропроводность), соответственно катиона и аниона, Ом-1 . м2 . моль-1.
λ∞[Ва2+] и λ∞[CO32-] находим по соответствующим таблицам:
λ∞[Ва2+] = 0,00637 Ом-1 . м2 . моль-1;
λ∞[CO32-] = 0,00693 Ом-1 . м2 . моль-1.
Тогда
λ∞(ВаСО3) = λ∞[Ва2+] и λ∞[CO32-] = 0,00637 + 0,00693 = 0,0133 Ом-1 . м2 . моль-1 или (См . м2 . моль-1).
Рассчитаем эквивалентную концентрацию соли в растворе из формулы:
λ∞ = χ/СN, где
СN — эквивалентная концентрация соли, моль/м3.
Тогда
СN(ВаСО3) = χ(ВаСО3)/λ∞ = 0,000536/0,0133 = 0,04 моль/м3 = 0,00004 моль/дм3.
Так как молярная концентрация CМ для ВаСО3 будет вдвое меньше нормальности:
СМ(ВаСО3) = 1/2СN(ВаСО3) = 0,00004/2 = 0,00002 моль/дм3.
Рассчитаем ПР(ВаСО3), получим:
СМ(ВаСО3) = [Ва2+] = [CO32-] = моль/дм3;
ПР(ВаСО3) = [Ва2+] . [CO32-] = 0,00002 . 0,00002 = 4 . 10-10 моль/дм3.
Ответ: ПР(ВаСО3) = 4 . 10-10 моль/дм3.
Как рассчитать произведение растворимости соли
Задача 310.
1. В 350 мл воды растворили 0,0135 г PbSO4 при 25 градусах. Вычислите ПР соли при этой температуре.
Решение:
m(PbSO4) = 0,0135 г;
М(PbSO4) = 303,26 г/моль;
V(p-pa) = 350 мл 0,35 л;
ПР(PbSO4) = ?
Рассчитаем массу PbSO4 в 1 л раствора из пропорции:
0,35 : 0,02 = 1 : х;
х = (0,02 . 1)/0,35 = 0,038 г.
Рассчитаем молярную концентрацию раствора по формуле: См(В) = m(B)/M(B), где
m(B) — масса растворенног вещества 1 л раствора, г;
M(B) — молярная масса растворенного вещества.
Тогда
См(В) = m(B)/M(B) = 0,038/303,26 = 0,000126 моль/л = 1,26 . 10-4 моль/л.
Уравнение диссоциации сульфата свинца:
PbSO4 = Pb2+ + SO42-.
При растворении каждого моля PbSO4 в раствор переходит 1 моль ионов Pb2+ и 1 моль ионов SO42-. Следовательно, в насыщенном растворе PbSO4 концентрации ионов составляют: [Pb2+] = 1,26 . 10-4 моль/л; [SO42-] = 1,26 . 10-4 моль/л.
Отсюда
ПР(PbSO4) = [Pb2+] . [SO42-] = (1,25 . 10-4) . (1,26 / 10-4) = 1,6 / 10-4.
Ответ: ПР(PbSO4) = 1,6 / 10-4.
Задача 311.
Определить ПР(PbBr2), если его растворимость 0,427 г/л?
Решение:
Sm(PbBr2) = 0,427 г/л;
M(PbBr2) = 367,008 г/моль.
ПР(PbBr2) = ?
Рассчитаем растворимость соли PbBr2 в молях, получим:
S = Sm(PbBr2)/M(PbBr2) = (0,427 г/л)/(367,008 г/моль) = 0,00116 моль/л.
Химическое равновесие в насыщенном растворе PbBr2 описывается уравнением:
PbBr2 = Pb2+ + 2Br—
Выражение произведения растворимости для PbBr2 имеет вид:
ПР(PbBr2) = [Pb2+] [Br—]2 = S · (2S)2 = 4S3
Вычислим произведения растворимости для PbBr2, получим:
ПР(PbBr2) = 4S3 = 4(0,00116)1/3 = 6,243584e-9 или 4,24 . 10-9.
Ответ: ПР(PbBr2) = 4,24 · 10-9.
Выпадение осадка при смешении солей
Задача 312.
В пробирке при комнатной температуре смешаны 1 мл 0,2 н раствора нитрата свинца и 2 мл 0,01 н раствора хлорида натрия. Выпадет ли осадок, если ПР(РbСl2) = 1,7 . 10-5?
Решение:
Уравнение реакции имеет вид:
Pb(NO2)2 + 2NaCl = PbCl2 + 2NaNO3.
При смешении растворов Pb(NO2)2 и NaCl объём смеси увеличится в 1,5 раза, следовательно, концентрации всех веществ уменьшатся тоже в 1,5 раза и становятся равными:
[Pb(NO2)2] = [Pb2+] = 0,2/1,5 = 0,133 моль/л;
[NaCl] = [Cl—] = 0,01/1,5 = 0,00666 моль/л.
Откуда
{[Pb2+] . [Cl—]2} = 0,133 . (0,00666)2 = 0,000044 моль/л = 4,4 . 10-5 моль/л;
4,4 . 10-5 > 1,7 . 10-5;
{[Pb2+] * [Cl—]2} > ПР(РbСl2).
Так как произведение концентраций ионов больше величины произведения растворимости, то осадок соли образуется.
Ответ: Да.
Вычисление растворимости соли
Задача 313.
Произведение растворимости иодида свинца при 20 градусах равно 8 . 10-9. Вычислить растворимость соли (в моль/л и г/л) при указанной температуре.
Решение:
Обозначим искомую растворимость PbI2 через S моль/л. Тогда в насыщенном растворе PbI2 содержится 1S моль/л ионов Pb2+ и 2S моль/л ионов I—.
Выражение произведения растворимости иодида свинца можно записать как:
ПР(PbI2) = [Pb2+] . [I—]2 = S * (2S)2 = 4S3.
Отсюда
S(PbI2) = [ПР(PbI2)/4]1/3 = [(8 . 10-9)/4]1/3 = 1,26 . 10-3 моль/л.
Ответ: S(PbI2) = 1,26 . 10-3 моль/л.
Вычисление концентрации ионов в насыщенном растворе
Задача 314.
Во сколько раз концентрация ионов серебра в насыщенном растворе иодида серебра больше, чем в насыщенном растворе сульфида серебра?
Решение:
ПР(AgI) = 8,3 . 10-17; [Ag+] = 8,3 . 10-17.
ПР(Ag2S) = 2,0 . 10-50; [Ag+] = 2(2,0 . 10-50) = 4 . 10-50.
Тогда
ПР(AgI)/ПР(Ag2S) = (8,3 . 10-17)/(4 . 10-50) = 2,075. 1033 раза.
Ответ: в 2,075 . 1033 раза.
Что такое проводимость воды?
Содержание:
1 Что такое проводимость воды?
2 единицы электропроводности
3 Как измерить соленость и TDS
4 Как преобразовать проводимость в концентрацию
5 Проводимость при очистке воды
Электропроводность (EC), или удельная проводимость, указывает на то, насколько хорошо среда проводит электричество. Мы знаем, что вода проводит электричество, поэтому не купаемся во время грозы и не пользуемся феном в ванной. Однако вода сама по себе не является хорошим проводником электричества. Чтобы вода проводила электричество, в ней должны присутствовать ионы. Электропроводность воды часто измеряется в промышленных и экологических приложениях как простой и недорогой способ определения количества присутствующих ионов.
Единицы электропроводности
Сегодня существует несколько различных единиц измерения электропроводности. Измерения проводимости часто конвертируются в единицы TDS, единицы солености или концентрации. Вот некоторые из этих распространенных единиц измерения:
| Единицы измерения | Описание |
| Mhos на метр (mho/m) | Старая единица измерения, эквивалентн S/m; так же ром |
| Электропроводность (EC) | Используется в кондуктометрах США. |
| Коэффициент проводимости (CF) | Используется в кондуктометрах Австралии. |
| Частей на миллион (ppm) | Единица измерения TDS |
| Миллиграммы на литр (мг/л) | Единица измерения TDS |
| Частей на тысячу (ppt) | Единица измерения солености |
Как измерить соленость и TDS
Используемые вами единицы измерения электропроводности будут зависеть от вашего местоположения и условных обозначений вашего приложения. В каждой отрасли есть предпочтительная единица проводимости. Обратите внимание, что TDS (выраженный в мг/л или ppm) на самом деле относится к количеству присутствующих ионов, а не к электропроводности. Однако, как упоминалось ранее, электропроводность часто используется для измерения количества присутствующих ионов. Измерители TDS измеряют электрическую проводимость и преобразуют значение в показания в мг/л или ppm. Электропроводность также является косвенным способом измерения солености. При измерении солености единицы обычно выражаются в ppt. Некоторые приборы для измерения электропроводности предварительно сконфигурированы с возможностью измерения солености, если это необходимо.
Обратите внимание, что измерения проводимости зависят от температуры и присутствующих ионных частиц.
Как преобразовать проводимость в концентрацию
Преобразование между проводимостью и TDS или соленостью зависит от химического состава образца. Измерения TDS обычно используются для мониторинга окружающей среды, где большинство растворенных твердых веществ являются ионными. Разные ионы производят разные значения электропроводности. Поскольку измерители TDS полагаются на один коэффициент пересчета для разных ионных частиц, измеренные значения TDS почти всегда будут немного отличаться от истинных значений TDS. Чтобы определить концентрацию по проводимости, необходимо знать ионный состав раствора.
- 1 S/m = s3 * A2 / кг * м3 где s — секунда, A — ампер, кг — килограмм, м — метр
- 1 mho/m = 1 rom = 1 S/m
- 1 EC = 1 µS/cm = 1 x 10-6 S/m
- 1 CF = 10 EC = 10 µS/cm = 1 x 10-5 S/m
- ppm500 = 500 x (проводимость в mS/cm) (США)
- ppm640 = 640 x (проводимость в mS/cm) (Европа)
- ppm700 = 700 x (проводимость в mS/cm) (Австралия)
- 1 mg/L = 1 ppm (при условии, что плотность воды составляет 1.00 g/mL)
Электропроводность при очистке воды
Разные применения требуют разного уровня чистоты воды. Например, электропроводность питьевой воды обычно составляет менее 1 mS/cm. Между тем, полупроводниковая и фармацевтическая промышленность требует исключительно чистой воды с еще более низким значением электропроводности, чем питьевая вода. Электропроводность чистой воды, используемой в таких приложениях, обычно составляет менее 1 µS/cm.
В таблице ниже приведены значения проводимости для некоторых распространенных растворов. Вы можете узнать больше о том, как измеряется проводимость для одного такого раствора, воды обратного осмоса (RO), в нашем блоге.
| Тип воды | Типичное значение проводимости |
| Сверхчистая вода | 0.05 µS/cm |
| Деионизированная (DI) вода | 0.05-1 μS/cm |
| Обратный осмос (RO) вода | 0.05-200 µS/cm |
| Питьевая вода | 200-800 µS/cm |
| Пресная вода | 0-1 mS/cm |
| Солоноватая вода | 1-46 mS/cm |
| Морская вода | 46-72 mS/cm |
| Рассол | 72+ mS/cm |
Электропроводность можно измерить с помощью двухэлектродных, четырехэлектродных или тороидальных (индуктивных) датчиков проводимости. Эти измерения электропроводности можно преобразовать в TDS, соленость и концентрацию.