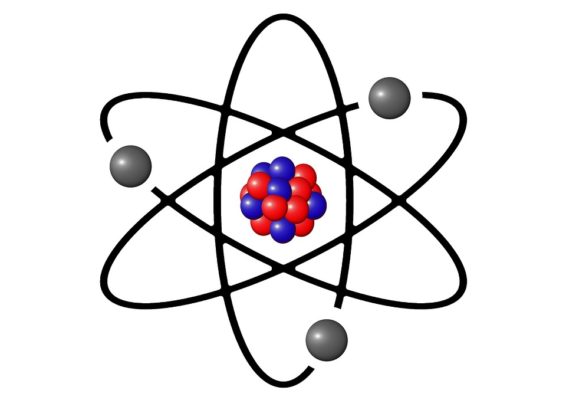
Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице.
Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Электроны с близкими значениями энергии образуют энергетический уровень (электронный слой).
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
Установлено, что максимальное число электронов на энергетическом уровне равно (2n²), где (n )— его номер. Значит, на первом уровне может находиться не более (2) электронов, на втором — не более (8), на третьем — не более (18) и т. д.
В атоме водорода — один электрон, и он располагается на первом энергетическом уровне:
В атоме гелия — два электрона. Первый энергетический уровень у гелия завершён, так как он не может содержать более двух электронов:
В атоме лития — три электрона. Два из них находятся на первом уровне. Третий электрон имеет большую энергию и движется дальше от ядра. В атоме лития появляется второй энергетический уровень:
У следующих элементов второго периода электроны добавляются на второй уровень:
;
B5)2)3
;
C6)2)4
;
N7)2)5
;
O8)2)6
;
F9)2)7
;
Ne10)2)8
.
У неона второй электронный слой завершён, так как содержит (8) электронов — максимально возможное число.
Заполнение третьего энергетического уровня начинается у атома натрия и завершается у атома аргона:
;
Mg12)2)8)2
;
Al13)2)8)3
;
Si14)2)8)4
;
P15)2)8)5
;
S16)2)8)6
;
Cl17)2)8)7
;
Ar18)2)8)8
.
Максимальное количество электронов на третьем слое равно (18), но у элементов третьего периода его заполнение не происходит, потому что внешний электронный слой не может содержать более (8) электронов.
Обрати внимание!
На внешнем электронном слое не может быть более (8) электронов.
У элементов четвёртого периода начинается заполнение четвёртого энергетического уровня:
;
Ca20)2)8)8)2
.
Полностью четвёртый электронный слой заполняется, как и в малых периодах, у инертного газа криптона.
Как найти электронный слой?
2. Число электронных слоев в атоме любого элемента равно номеру периода, в котором он находится. 3. На внешнем электронном слое атомов максимально может находиться не более восьми электронов.
Как определить завершенный внешний электронный слой?
Если рассматривать первый слой на котором может находиться только два электрона. Если на нем два электрона значит он завершенный, а если один электрон значит незавершенный и для завершения не хватает одного электрона. То есть чтобы электрон был завершенный на нем должно находиться максимальное число электронов.
Что такое электронный слой?
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии. Энергетические уровни нумеруют, начиная с самого близкого к ядру. Установлено, что максимальное число электронов на энергетическом уровне равно 2n², где n — его номер.
Что такое внешний энергетический уровень?
energy levels) — это те значения энергии, которые может принимать электрон в атоме. … д., пока от атома не «оторвется» и атом не превратится в ион. Поэтому употреблять такие фразы как внешний энергетический уровень, или в атоме водорода один энергетический уровень, крайне некорректно.
Как определить внешний энергетический уровень?
Число энергетических уровней в атоме определяется номером периода. Число электронов на последнем внешнем уровне равно номеру группы. Максимальное число электронов на энергетическом уровне определяется формулой N = 2 * n^2 , где N — общее число электронов на энергетическом уровне, n — номер уровня.
Что такое энергетические уровни?
Энергетический уровень — собственные значения энергии квантовых систем, то есть систем, состоящих из микрочастиц (электронов, протонов и других элементарных частиц) и подчиняющихся законам квантовой механики.
Как изображают энергетические уровни?
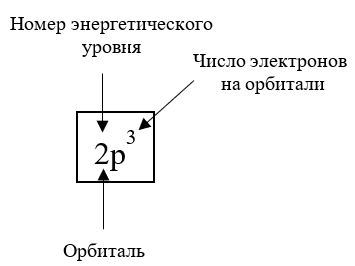
Энергетический уровень — совокупность АО с близкими значениями энергии. … Подуровни изображаются с помощью цифр и букв: цифра отвечает номеру энергетического уровня (электронного слоя), буква — природе АО, формирующей подуровни (s-, p-, d-, f-), например: 2p-подуровень (2p-АО, 2p-электрон).
Что такое атомные орбитали?
Атомная орбиталь (АО) — область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
Как заполнять электронные уровни?
Порядок заполнения энергетических подуровней (см. рис.) можно запомнить в виде ряда: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s….
Как заполнять электронные орбитали?
Порядок заполнения орбиталей следующий: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p. Обратите внимание, что приведенная выше запись, когда заполнены все орбитали, является электронной конфигурацией элемента Uuo (унуноктия) 118, атома периодической системы с самым большим номером.
Как заполнять атомные орбитали?
Обычный порядок заполнения атомных орбиталей: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f =5d < 6p < 7s < 5f=6d … Количество орбиталей на каждом электронном уровне. 2.
Как записываются электронные конфигурации атомов?
Как записываются электронные конфигурации атомов? … Записываются электронные конфигурации следующим образом, в начале указывается номер энергического уровня на котором расположена орбиталь и тип орбитали (например, 1s), далее надстрочным индексом обозначают число электронов на орбиталях данного типа (например, 1s2).
Как найти электронную конфигурацию атома?
Для изображения конфигурации атома (строения электронных оболочек) необходимо знать:
- Место элемента в периодической таблице Д. И. Менделеева.
- Общее число электронов в атоме (равно порядковому номеру).
- Максимальное число электронов на уровне (2n2).
- Порядок заполнения электронами подуровней и орбиталей, т. е.
Чему соответствует верхний индекс в электронной формуле?
каждому энергетическому уровню соответствует порядковый номер, обозначаемый арабской цифрой; за номером следует буква, означающая орбиталь; над буквой пишется верхний индекс, соответствующий количеству электронов на орбитали.
Что такое электронная конфигурация внешнего слоя?
Электронная конфигурация — это конкретное распределение электронов по орбита-лям атома. … Энергетический уровень, занятый электронами, называется электронным слоем или электронной оболочкой. Валентные электроны -электроны, принимающие участие в образовании химических связей.
Что такое электронная конфигурация?
Электро́нная конфигура́ция — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы. Электронная конфигурация обычно записывается для атомов в их основном состоянии. Для определения электронной конфигурации элемента существуют следующие правила: Принцип заполнения.
Какие элементы имеют одинаковую электронную конфигурацию?
Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- Cr.
- Al.
- K.
- N.
- Cl.
Что такое электронная формула что она показывает?
Электронная формула (конфигурация) атома химического элемента показывает расположение электронов на электронных оболочках (уровнях и подуровнях) в атоме или молекуле. Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Что такое электронная оболочка атома?
Электронная оболочка атома — область пространства наиболее вероятного нахождения электронов, имеющих одинаковое значение главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях.
Как научиться писать электронную формулу?
Алгоритм составления электронной формулы элемента:
- Определите число электронов в атоме используя Периодическую таблицу химических элементов Д. …
- По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
Что такое электронный провал?
«Провал» электрона — переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций. Подобное явление наблюдается у меди и хрома.
Как определить валентность элементов?
Алгоритм определения валентности по формулам химических элементов.
- Записать формулу химического соединения.
- Обозначить известную валентность элементов.
- Найти наименьшее общее кратное валентности и индекса.
- Найти соотношение наименьшего общего кратного к количеству атомов второго элемента.
Как определить валентность по таблице?
Номер группы, в которой расположен атом в периодической таблице равен его высшей валентности. Низшая валентность определяется разницей между числом восемь и номером группы. Натрий и алюминий имеют только одно значение валентности, равное номеру группы.
Что такое валентность простыми словами?
Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей.
Как определить валентность элемента 7 класс?
Для определения валентности по химической формуле или при составлении формул по валентности необходимо придерживаться принципа, что общее число связей всех атомов одного элемента в соединении равно общему числу связей всех атомов другого элемента.
Как узнать высшую валентность элемента?
Правила определения валентности элементов в соединениях Высшая валентность равна номеру группы. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т. е. 8 – № группы.
Как писать валентность?
Значения валентности записывают римскими цифрами над химическими символами. За единицу валентности принята валентность атомов водорода. Валентность атома элемента в его водородном соединении равна числу атомов водорода в молекуле.
Что такое валентность объясните примерами?
Валентность-способность атомов присоединять и удерживать определенное число атомов химического элемента. Например:CuO Валентность меди по таблице Менделеева 2(см. на номер группы,именно по ней определяется валентность),а валентность кислорода всегда равна 2,т. к в соединениях кислород проявляет низшую валентность.
Строение электронных оболочек
Первые упоминая об атоме появились еще в Древней Греции, в писаниях философа Демокрита. он говорит о нем как о неделимой частице. Дальнейшее учение продолжилось в 18 веке российским ученым М.В. Ломоносовым, а после английским Дж. Дальтоном.
Более точное строение описал английский ученый в 1911 году Э. Резерфорд, проводя опыты он выяснил, что атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов, данная модель получила название «Планетарная модель атома».
В ходе ряда опытов, было выяснено, что число протонов (p) равно порядковому номеру, а так как атом в целом нейтральная частица, то число отрицательных частиц равно числу положительных, т.е. число электронов (ē) равно числу протонов, а также заряду атома (Z).
Вся масса (Ar) сосредоточена в ядре, ядро состоит из протонов и нейтронов (n), массу можно посмотреть в периодической системе, следовательно, можно найти число нейтронов:
p = ē = Z = порядковому номеру
n = Ar – p
Теперь разберем более подробное строение электронной оболочки. Вокруг ядра есть энергетические уровни (электронный слой), их количество равно номеру периода, на каждом электронном слое может находиться определенное число электронов, максимальное число электронов на уровне можно найти по формуле:
N = 2n2, где n – это номер энергетического уровня
n = 1, N=2*12 = 1
n = 2, N = 2*22 = 8 и так далее
Последний (внешний) уровень у элемента в большинстве случаев не заполнен полностью, число электронов на внешнем уровне для главных подгрупп равно номеру группы, например, барий элемент IIA группы, значит на внешнем уровне будет 2 электрона, а у фосфора будет 5, т.к. он элемент VA группы.
Рассмотрим алгоритм распределения электронов по энергетическим уровням:
-
Находим элемент в периодической системе, записываем символ элемента и заряд ядра = порядковому номеру со знаком +
-
Находим число энергетических уровней = номеру периода
-
До третьего периода ставим максимальное число электронов на уровне кроме внешнего (на 1 – 2 электрона, на 2 – 8 электронов)
-
На внешнем уровне для главных подгрупп число электронов = номеру группы
-
Для элементов, начиная с 4 периода, предвнешний уровень заполняем в последнюю очередь, сначала первые заполняем максимально, затем внешний для главных подгрупп по номеру группы, после из всех электронов элемента вычитаем сумму тех, что записали, и записываем на предвнешнем уровне
-
Сумма всех электронов должна быть равна порядковому номеру
Примеры:
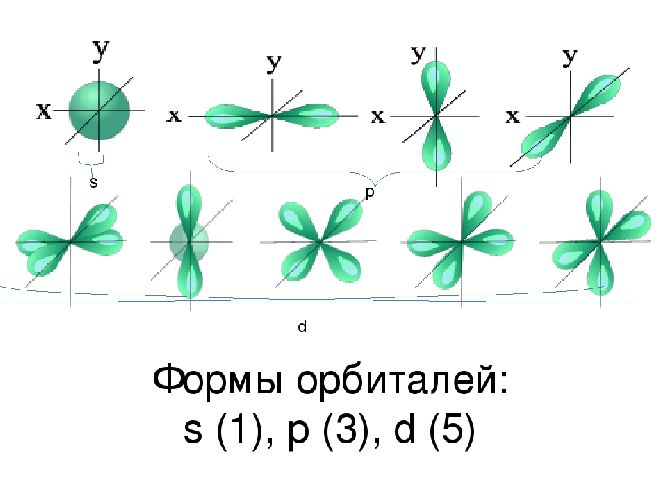
Электроны вращаются вокруг ядра не хаотично, а строго по определенной траектории, как планеты по своим орбитам, в атоме их называют электронными облаками или орбиталями, выделяют 4 вида орбиталь, каждая орбиталь содержит определенное число электронов:
s — 2 ē
p — 6 ē
d — 10 ē
f — 16 ē
Все энергетические уровни начинаются с s-орбитали, с каждым новым дополняется по новой, т.е. на 1 – s, на 2 – s и p, на 3 s, p и d…
Электронную формулу записываем в последовательности: 1s 2s 2p 3s 3p 4s 3d 4p
Пример:
Углерод элемент 2 периода, электроны расположены на 1s 2s 2p орбиталях, всего 6 электронов, распределяем 1s2 2s2 2p2
Хлор элемент 3 периода, электроны расположены на 1s 2s 2p 3s 3p орбиталях, всего 17 электронов, распределяем 1s2 2s2 2p6
Строение электронных оболочек атомов

4.7
Средняя оценка: 4.7
Всего получено оценок: 1706.
4.7
Средняя оценка: 4.7
Всего получено оценок: 1706.
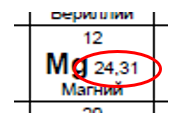
Атом – мельчайшая частица вещества, состоящая из ядра и электронов. Строение электронных оболочек атомов определяется положением элемента в Периодической системе химических элементов Д. И. Менделеева.
Электрон и электронная оболочка атома
Атом, который в целом является нейтральным, состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки (электронное облако), при этом, суммарные положительные и отрицательные заряды равны по абсолютной величине. При вычислении относительной атомной массы массу электронов не учитывают, так как она ничтожно мала и в 1840 раз меньше массы протона или нейтрона.
Электрон – совершенно уникальная частица, которая имеет двойственную природу: он имеет одновременно свойства волны и частицы. Они непрерывно движутся вокруг ядра.
Пространство вокруг ядра, где вероятность нахождения электрона наиболее вероятна, называют электронной орбиталью, или электронным облаком. Это пространство имеет определенную форму, которая обозначается буквами s-, p-, d-, и f-. S-электронная орбиталь имеет шаровидную форму, p-орбиталь имеет форму гантели или объемной восьмерки, формы d- и f-орбиталей значительно сложнее.
Вокруг ядра электроны расположены на электронных слоях. Каждый слой характеризуется расстоянием от ядра и энергией, поэтому электронные слои часто называют электронными энергетическими уровнями. Чем ближе уровень к ядру, тем меньше энергия электронов в нем. Один элемент отличается от другого числом протонов в ядре атома и соответственно числом электронов. Следовательно, число электронов в электронной оболочке нейтрального атома равно числу протонов, содержащимся в ядре этого атома. Каждый следующий элемент имеет в ядре на один протон больше, а в электронной оболочке – на один электрон больше.
Вновь вступающий электрон занимает орбиталь с наименьшей энергией. Однако максимальное число электронов на уровне определяется формулой:
N=2n2,
где N – максимальное число электронов, а n – номер энергетического уровня.
На первом уровне может быть только 2 электрона, на втором – 8 электронов, на третьем – 18 электронов, а на четвертом уровне – 32 электрона. На внешнем уровне атома не может находится больше 8 электронов: как только число электронов достигает 8, начинает заполняться следующий, более далекий от ядра уровень.
Строение электронных оболочек атомов
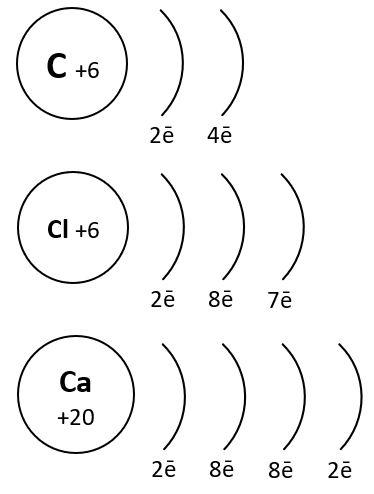
Каждый элемент стоит в определенном периоде. Период – это горизонтальная совокупность элементов, расположенных в порядке возрастания заряда ядер их атомов, которая начинается щелочным металлом, а заканчивается инертным газом. Первые три периода в таблице – малые, а следующие, начиная с четвертого периода – большие, состоят из двух рядов. Номер периода, в котором находится элемент имеет физический смысл. Он означает, сколько электронных энергетических уровней имеется в атоме любого элемента данного периода. Так, элемент хлор Cl находится в 3 периоде, то есть его электронная оболочка имеет три электронных слоя. Хлор стоит в VII группе таблицы, причем в главной подгруппе. Главной подгруппой называется столбец внутри каждой группы, который начинается с 1 или 2 периода.
Таким образом, состояние электронных оболочек атома хлора таково: порядковый номер элемента хлора – 17, что означает, что атом имеет в ядре 17 протонов, а в электронной оболочке – 17 электронов. На 1 уровне может быть только 2 электрона, на 3 уровне – 7 электронов, так как хлор находится в главной подруппе VII группы. Тогда на 2 уровне находится:17-2-7=8 электронов.
Что мы узнали?
Тема «Строение электронных оболочек атомов» по химии (8 класс) кратко объясняет строение атома, свойства и расположение электронов. Также она дает представление о распределении электронов по уровням в периодической системе Д. И. Менделеева.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Никита Губский
7/10
-
Антон Неврамов
10/10
-
Александр Алишевич
7/10
-
Паша Кривов
10/10
-
Александр Котков
10/10
-
Саша Штрейкер
8/10
-
Тимур Насыров
10/10
-
Фыафыафыа Фыафыа
10/10
-
Ангелина Шумовская
8/10
-
Al Unicorn
9/10
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 1706.
А какая ваша оценка?
На этой странице вы узнаете
- Чем атом похож на Солнечную систему?
- Один водород, но три лучше: что такое изотопы?
- Как умеет скакать электрон?
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц. У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
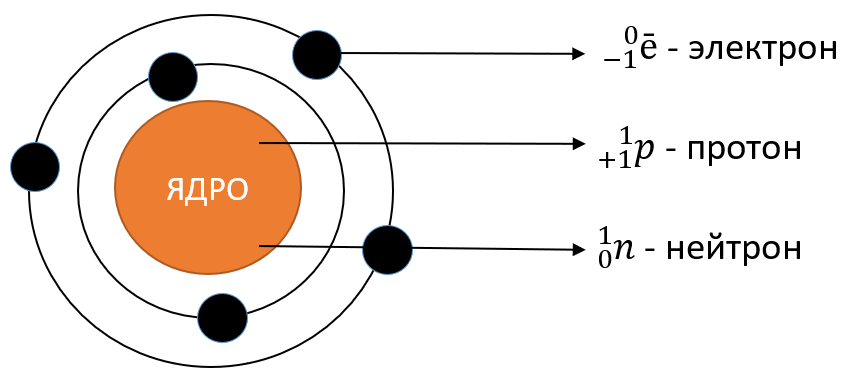
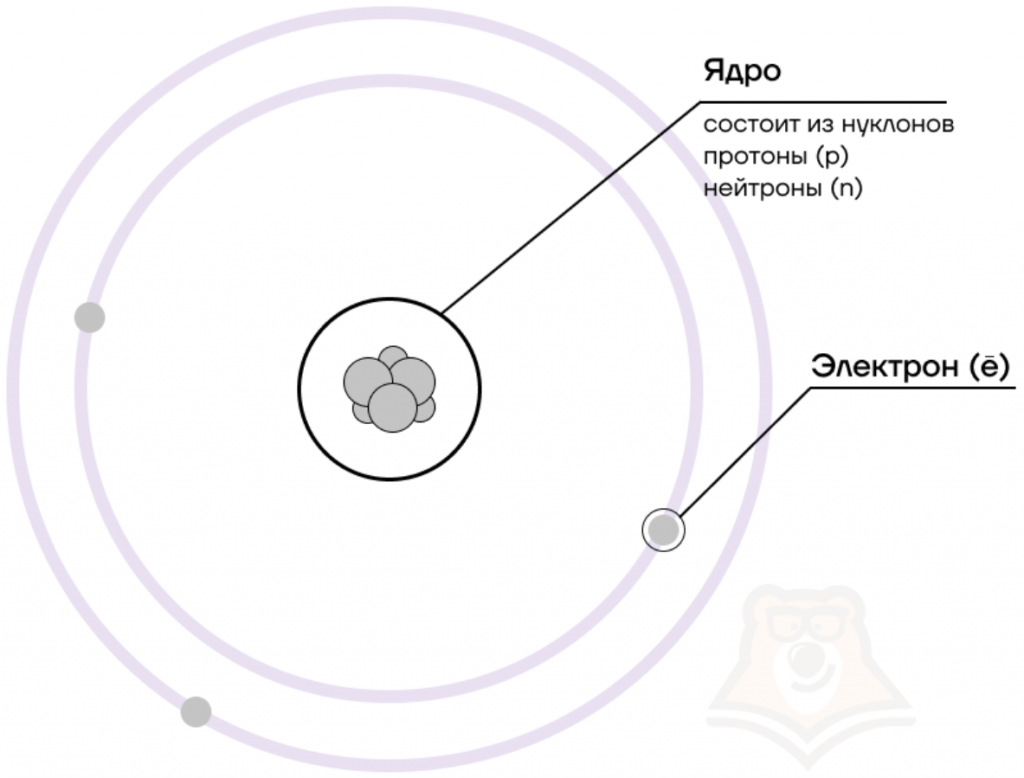
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
Чем атом похож на Солнечную систему?
Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями.
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Каждая из элементарных частиц в атоме имеет свой заряд и массу:

Характеристика элементарных частиц
Из таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
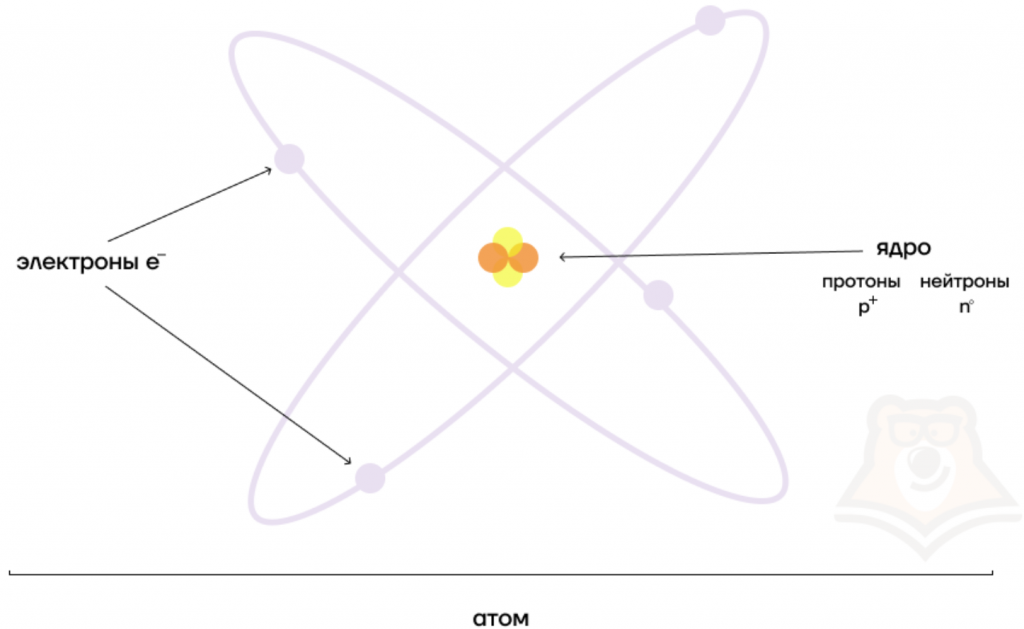
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.

Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий. Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
Изотопы — атомы одного химического элемента с разным числом нейтронов: равные заряды ядра, равное число e и p, но разное число n!
Как определить количество элементарных частиц
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:

В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
(№ элемента = p = Z = ē)
Число нейтронов = массовое число – порядковый номер
(n = Ar — № элемента)
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.
- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.

На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
“Грустный” и “веселый” атом
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.

Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → …
Проскок электрона
Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация.
Такое явление называется проскоком электрона: электрон как бы нарушает общую очередь элементов в оболочке и обходит их.
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s11

Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9. Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний.
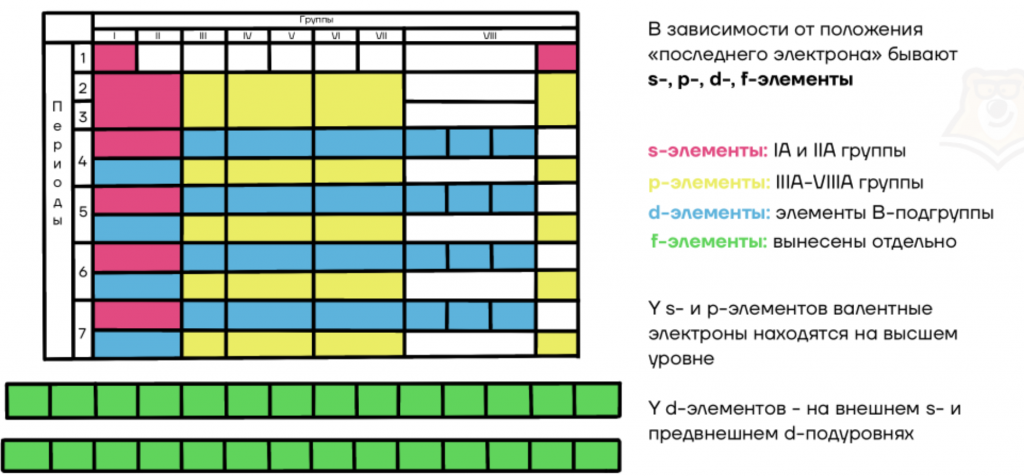
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.

Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек
- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.
Проверь себя
Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
- Натрия
- Алюминия
- Ксенона
- Меди
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.